
下列基态原子的电子排布图中,正确的是( )
|
| A. |
| B. |
| C. |
| D. |
|
科目:高中化学 来源: 题型:
向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)()
A. 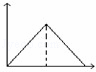 B.
B. 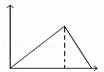 C.
C. 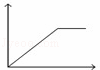 D.
D. 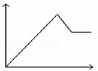
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是()
A. Na+、Fe2+、Cl﹣、ClO﹣ B. Na+、Cu2+、SO42﹣、NO3﹣
C. Mg2+、NH4+、SO42﹣、Cl﹣ D. Ba2+、HCO3﹣、NO3﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数
据回答下列问题:
(1)该盐酸中HCl的物质的量浓度为 mol•L﹣1
(2)某同学用上述浓盐酸和蒸馏水配制浓度为0.4mol•L﹣1体积为425mL的稀盐酸.
①该学生需要取 mL上述浓盐酸进行配制.
②配制过程中,所用到的仪器除烧杯、玻璃棒、量筒外还需 、 .
③上述实验中,需要用到玻璃棒,其作用是 、 .
④在配制过程中,下列操作对配制的稀盐酸的物质的量浓度有何影响(填“偏 大”、“偏小”或“无影响”)
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面
Ⅱ.定容时仰视刻度线 .

查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
|
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 |
|
| B. | 水加热到很高的温度都难以分解 |
|
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
|
| D. | 水结成冰体积膨胀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
|
| A. | N2分子有一个δ键,两个π键 |
|
| B. | δ键比π键重叠程度大,形成的共价键一定强 |
|
| C. | 两个原子间形成共价键时,最多有一个δ键 |
|
| D. | 气体单质中,一定有δ键,可能有π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
我国著名化学家张青莲教授主持测定的锌、锗等元素的相对原子质量数值,被国际原子量委员会采用为国际新标准.下表是元素周期表的一部分,下列说法正确的是( )
| 30 Zn 锌 65.38 | 32Ge 锗 72.63 |
|
| A. | 锌原子核内有32个质子 |
|
| B. | 锌元素的相对原子质量为65.38 |
|
| C. | 锗属于非金属元素 |
|
| D. | 锗原子中的中子数为32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程示意图如下所示,完成下列填空:
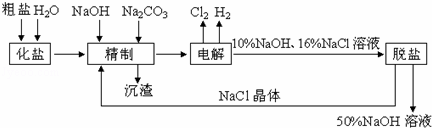
(1)在电解过程中,与电源正极相连的电极上电极反应为 ,与电源负极相连的电极附近,溶液pH (选填“不变”、“升高”或“下降”).
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为 .
(3)如果粗盐中SO42﹣含量较高,必须添加钡试剂除去SO42﹣,该钡试剂不能是b.
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42﹣,加入试剂不合理的顺序为 (选填a、b、c)
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过 、冷却、 (填写操作名称)除去NaCl.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com