
| 实验事实 | |
| 事实一 | 水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气. |
| 事实二 | 盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用. |
| 事实三 | 普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解. |
| 事实四 | 在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2. |
| 事实五 | 1g(0.036mol)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL). |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
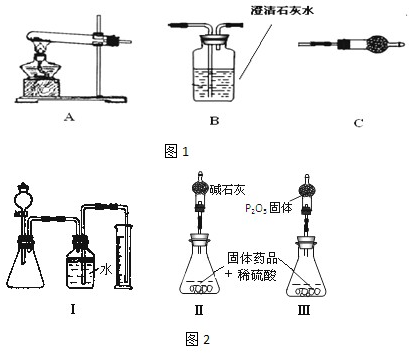
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
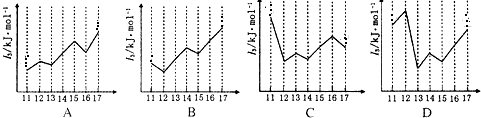
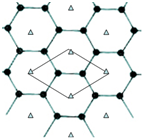
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4 mol |
| B、小于0.2 mol |
| C、0.2 mol |
| D、大于0.2 m01而小于0.4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验操作 | 现象与结论 | 离子方程式 |
| 第1步 | 取2~3mL溶液装于试管,向试管中滴加几滴KSCN溶液 | ||
| 第2步 | 若溶液紫色褪去,则溶液 含有Fe2+;若无明显变化, 则不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它是一种共价化合物 |
| B、在加热条件下不能产生有色气体 |
| C、它能与NaOH溶液反应 |
| D、该化合物中每个原子都能满足8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com