
【题目】等物质的量的N2、O2、CO2混合气体通过一定量Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为( )
A. 6: 7: 3 B. 3: 3: 2
C. 3: 4: 1 D. 6: 9: 0
【答案】C
【解析】
氧气和氮气都不和过氧化钠反应,二氧化碳和过氧化钠反应生成氧气,根据阿伏加德罗定律,同温同压下气体的体积之比等于物质的量之比,由反应前后体积的变化判断出二氧化碳有剩余,再根据反应的化学方程式分析解答。
设三者的物质的量分别为3 mol,发生的反应为:2Na2O2+2CO2=2Na2CO3+O2,现气体体积变为原来的![]() ,即剩余气体的物质的量为8 mol。若二氧化碳完全与过氧化钠反应,则气体的物质的量减少数1.5 mol,即剩余气体为7.5 mol,说明二氧化碳有剩余;设有xmol二氧化碳参加反应,2Na2O2+2CO2=2Na2CO3+O2
,即剩余气体的物质的量为8 mol。若二氧化碳完全与过氧化钠反应,则气体的物质的量减少数1.5 mol,即剩余气体为7.5 mol,说明二氧化碳有剩余;设有xmol二氧化碳参加反应,2Na2O2+2CO2=2Na2CO3+O2
2 1
xmol 0.5xmol
则反应后,气体的物质的量为3+3+0.5x+(3-x)=8,解得x=2,所以反应后N2的物质的量为3mol,O2的物质的量为3+0.5x=4mol,CO2的物质的量为1mol,混合气体中N2、O2、CO2的物质的量之比为3:4:1,故C正确。
故选C。


科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是

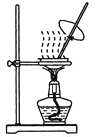
甲 乙 丙 丁
A. 用装置甲进行中和热的测定
B. 用装置乙制取CO2气体
C. 用装置丙蒸发CH3COONa溶液得CH3COONa晶体
D. 用装置丁模拟工业制氨气并检验产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里要配制400mL0.2mol/L的硫酸钠溶液。实验步骤如下:
A.在天平上称出_______g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解。
B.把得到的溶液冷却后小心地沿着__________注入_______________ 中。
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中。
D.继续向容量瓶中加蒸馏水至液面距刻度l~2cm处,改用________小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切。
E.将瓶塞塞紧,充分摇匀。
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶。
(1) 请填写上述空白处。
(2) 下列情况会使所配溶液浓度偏低的是___________(填序号)。

a.某同学定容时观察液面的情况如图所示
b.没有进行上述的操作步骤C
c.摇匀后发现液面低于刻度线
d.B操作时将少量液体洒到外面
e.容量瓶用前内壁沾有水珠
(3) 如果实验室用18mol/L的浓硫酸配制3. 6mol·L-1的稀硫酸250mL。计算所需浓硫酸的体积为___________mL,在实验时应用_________量取浓硫酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸试剂瓶标签上的内容:
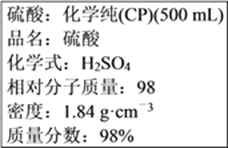
计算:
(1)该硫酸的物质的量浓度是________mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要90 mL 4.6 mol·L-1的稀硫酸,则配制稀硫酸时需要取________mL的该硫酸;配制时需选用的仪器主要有量筒、烧杯、玻璃棒、_______、_______(在横线上填写所缺仪器的名称)。其中配制稀硫酸溶液时定容的操作为 ___________ 。
(3)该硫酸与等质量的水混合后所得溶液中溶质的物质的量浓度________9.2 mol·L-1。(填大于或等于或小于)
(4)配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是 ______(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤用量筒量取浓硫酸时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸性溶液中只有Na+、CH3COO﹣、H+、OH﹣四种离子.则下列描述正确的是
A. 该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B. 该溶液可由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C. 加入适量NaOH,溶液中离子浓度为c(CH3COO﹣)>c(Na+ )>c(OH﹣)>c(H+)
D. 加入适量氨水,c(CH3COO﹣)一定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含有少量KC1、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如下图所示。
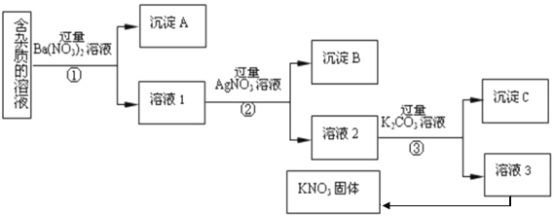
注:KNO3固体容易受热分解
(1)沉淀A的主要成分是___________、___________(填化学式);
(2)为了除去溶液3中的杂质,可以向其中加入适量的___________;除杂后从溶液3获得KNO3晶体的操作是___________、___________、过滤;
(3)步骤③加入过量K2CO3溶液的目的是___________;
(4)实验室用上述实验获得的KNO3体配制450mL0.40 mol/L KNO3溶液,需称取KNO3固体的质量是_____g;
(5)下列操作会导致所配溶液浓度偏大的是(___________)
A.使用了生锈的砝码
B.定容时仰视刻度线
C.容量瓶使用前用蒸馏水洗净但没有干燥
D.固体溶解后未冷却到室温就转移到容量瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )

A. 装置①常用于分离互不相溶的液体混合物
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
D. 装置③可用于收集H2、CO2、Cl2、NH3等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了x g,则( )
A. 电解液质量增加x g B. 阴极质量增加x g
C. 阴极质量增加a g,a>x D. 阴极质量增加b g,b<x
查看答案和解析>>
科目:高中化学 来源: 题型:
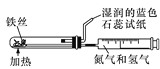
【题目】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):

(1)设计装置A的目的是________________________________________,为达此目的应进行的操作____________________________________________________________________________;A中反应的化学方程式是_________________________________________________________。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是_______;B中反应的离子方程式是_________________________________________________________。
(3)装置E和F的作用是__________________________________________________________,为实现此目的,操作方法是_______________________________________________________。
(4)D装置的作用是_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com