
【题目】阅读材料,完成下列问题。
海底盐池是近些年海洋科学家的一项重要发现,分布在世界多处埋有盐层的海域,目前人类已探明的海底盐池主要分布在红海、地中海、墨西哥湾、黑海、南极大陆架。盐池池面与普通海水之间有着清晰可见的分界。数不清的贝类与鱼虾在波光粼粼的盐池周围生活,但一旦生物进入盐池内就会死亡。研究人员还从盐池中采集了可以适应池中环境的生物样本,分析之后认为这类生物可能会在太阳系中某一行星上生存,甚至可能在太阳系之外也会存在。
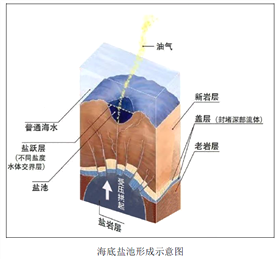

(1)结合材料,分析海底盐池的形成条件。
(2)简析池面与普通海水之间有明显分界的原因。
(3)推测生物一旦进入这个海底盐池就会死亡的原因。
(4)“海底盐池”会受到哪些领域专家的关注,并简述对“海底盐池”开展科考的现实意
【答案】(1)海底有低洼地带或海底盆地;海洋盆地深部必须赋存有盐岩层或高矿化度盐水;供盐岩层或高矿化度盐水渗漏的流体通道,如海底地层断裂产生的缝隙;有足够大的内部压力(答1点任答3点以上)(2)盐池水密度比正常海水高,明显的密度差导致海水分层的形成;海洋底部水流相对稳定,盐池与正常海水之间就形成了明显的分界面(3)盐池水高盐、缺氧、可能有毒(盐池水高盐为必答点,任答2点以上)(4)会受到地质学家、地理学家、化学家、生物学家的关注;意义:促进人类对深海生态环境的了解;促进海洋资源开发;促进海洋化学和生物研究;促进地外生命的研究(任答3点)
【解析】(1)据材料和图分析可知,海底盐池的形成是因为海底深部存在有盐岩层,提供盐分,同时据图分析可知,海底深部发育超压流体,有足够大的内部压力,盐池水密度大,易沉于洼地,形成盐池。
(2)据材料可知,盐池水密度比正常海水更高,因此明显的密度差导致海水分层的形成;同时因海洋底部水流相对稳定,盐池与正常海水之间就形成了明显的分界面。
(3)生物一旦进入这个海底盐池就会死亡,说明海水盐池的生存环境不适合一般的动物生存。原因主要是去盐度高,与普通海水不同。
(4)“海底盐池”因其特殊的位置、特殊的生存环境等会受到地质学家、地理学家、化学家、生物学家的关注。对“海底盐池”的研究,意义应从海洋生物资源研究、海洋生态环境认识、以及探索地外文明等方面有重要意义。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
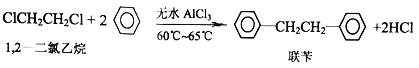
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
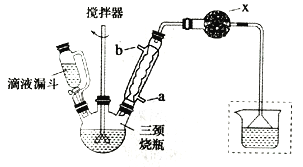
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称 | 相对分子质量 | 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶于水,可溶于苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的优点是_______________________;球形冷凝管进水口是____________(选填“a”或“b”)
(2)仪器X的名称是________________;装置中虚线部分的作用是____________。
(3)洗涤操作中,用2%Na2CO3溶液洗涤的目的是___________;水洗的目的是____________。
(4)在进行蒸馏操作时,应收集____________℃的馏分。
(5)该实验中,联苄的产率约为____________%(小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL容量瓶中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴____作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________ mL。
![]()
(4)滴定。当___________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录:
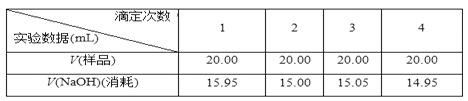
Ⅲ.实验处理:
(5)某同学在处理数据时计算得:平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。 指出他的计算的不合理之处:_____;按正确数据处理,可得市售白醋总酸量=______ g/100 mL。(结果保留四位有效数字)
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号)________。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗 b.碱式滴定管尖嘴滴定前有气泡,滴定后消失
c.锥形瓶中加入待测白醋溶液后,再加少量水 d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是

A. Kb2的数量级为10-8
B. X(OH)NO3水溶液显碱性
C. 等物质的量的X(NO3)2和X(OH)NO3混合溶液中 c(X2+)>c[X(OH)+]
D. 在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:Ti(s) +2Cl2(g) = TiCl4(l) △H = -804.2 kJ ·mol-1;
2Na(s) +Cl2(g) = 2NaCl(s) △H = -882.0 kJ ·mol-1
Na(s) = Na(l) △H =2.6 kJ ·mol-1
请写出用液态钠与四氯化钛置换出钛的热化学方程式__________________________。
(2)已知:向一个体积恒定为2L的密闭容器中充入4mol A、1mol B,发生如下反应:4A(g)+B(s) ![]() 3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
3C(s)+4D(g)。该反应中各物质的摩尔质量(单位g·mol-1)都不一样,在一定条件下该反应2分钟达到平衡。
①不能够说明该反应已达到平衡的是:________。
A.恒温下,容器内的压强不再变化
B.恒温下,容器内混合气体的密度不再变化
C.一定条件下,D的体积分数保持不变
D.一定条件下,单位时间内消耗4molA的同时生成1 mol B
②平衡后测得D的浓度为0.3mol·L-1,则从反应开始到平衡时,A的平均反应速率为________,B转化率为________。
(3)用活性炭还原法可以处理氮氧化物,有关反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
N2(g)+CO2(g);△H,向某密闭容器加入一定量的活性炭和NO,在t℃下反应,有关数据如图:
NO | N2 | CO2 | |
起始浓度/molL─1 | 0.10 | 0 | 0 |
平衡浓度/molL─1 | 0.04 | 0.03 | 0.03 |
①在t℃下,该反应的平衡常数为________(保留两位有效数字)。
②平衡后升高温度,再次达到平衡,测得容器中NO、N2、CO2的浓度之比为2:1:1,则该反应的
ΔH________0(填“>”、“<”或“=”),此时NO的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)固体B的主要用途为(只写一种即可)______________;
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是:___________、_______________;
(3)第③步中,生成氢氧化铝的离子方程式是___________________。若往A溶液中通入足量CO2,产生的沉淀为____________________(填化学式);
(4)工业上制取AlCl3常用Al2O3与C、Cl2在高温条件下反应,已知每消耗0.5mol碳单质,转移1mol电子,则该反应的氧化产物为_____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要配制500mL0.10mol/LNa2CO3溶液。
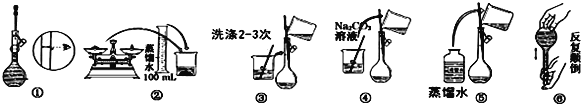
(1)所需玻璃仪器有:玻璃棒、烧杯、量筒、______、______。
(2)实验时图中所示操作的先后顺序为______(填编号)。
(3)在配制过程中,下列操作对所配溶液浓度如何?(填“偏高”、“偏低”或“无影响”)
①转移溶液后没有洗涤烧杯和玻璃棒______;
②向容量瓶加水定容时俯视液面______;
③摇匀后液面下降,再加水至刻度线______。
(4)所需Na2CO3固体的质量为__g;若改用浓溶液稀释,需要量取2mol/LNa2CO3溶液__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组,探究一定量的浓硫酸与足量锌充分反应产生的气体产物,进行如下实验:按图组装好实验装置,在A中加入5 mL 98%的浓硫酸和足量的锌粒,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加。
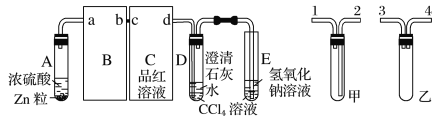
试回答下列问题:
(1)写出A中从反应开始到停止可能发生反应的化学方程式:_________________________________________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、____接b,c接____、____接d;D、E两支试管中CCl4的作用是_______________________________。
(3)能证明浓硫酸具有强氧化性的实验现象为___________________________________;反应较长时间后气泡量又会明显增加的原因是_________________________________。
(4)D中浑浊消失的离子反应方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在高温条件下与氧化铜反应:2Fe+3CuO![]() Fe2O3+3Cu。铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2,一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液(表示为“甲”)于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙。下列判断正确的是( )
Fe2O3+3Cu。铜在氯化铁溶液中发生反应:Cu+2FeCl3=2FeCl2+CuCl2,一定质量的铁与氧化铜的混合物,在高温条件下恰好完全反应.将反应后的固体粉末倒入盛有足量稀盐酸的烧杯中,振荡,充分反应后静置,然后从烧杯中取适量溶液(表示为“甲”)于试管中,并加入一定质量的锌粉,充分反应后过滤,得到滤液乙和固体丙。下列判断正确的是( )
①甲中含有FeCl3;②甲中不含FeCl3;③若向固体丙加稀盐酸无明显现象,则滤液乙中一定含有ZnCl2、FeCl2,可能含有CuCl2;④若向固体丙加稀盐酸有气体产生,则滤液乙中可能含有ZnCl2、FeCl2,一定不含有CuCl2。
A. ①③ B. ②③ C. ①④ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com