
| A. | 中性溶液Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | $\frac{{K}_{W}}{c{(H}^{+})}$=10-13mol•L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3- | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、H+、ClO-、SO42- |
分析 A.中性溶液中,这几种离子之间不反应,不反应的离子能大量共存;
B.加入苯酚显紫色的溶液中含有铁离子;
C.该溶液为酸性溶液,离子之间不反应且和氢离子不反应的能大量共存;
D.碘离子具有还原性,能被强氧化性离子氧化.
解答 解:A.中性溶液中,这几种离子之间不反应,所以能大量共存,故A正确;
B.加入苯酚显紫色的溶液中含有铁离子,铁离子和碘离子发生氧化还原反应而不能大量共存,故B错误;
C.该溶液为酸性溶液,H+和[Ag(NH3)2]+、OH-反应而不能大量共存,故C错误;
D.碘离子具有还原性,能被强氧化性离子氧化,酸性条件下,次氯酸根离子和碘离子发生氧化还原反应而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,涉及复分解反应、氧化还原反应,注意隐含条件的挖掘,易错选项是B.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=6.2×10-10 | K=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入C02:2F-+H2O+CO2═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 | |
| D. | 三种酸的酸性由强到弱为:HF>H2C03>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
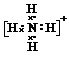 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8gO2含有4NA个电子 | |
| B. | 1molN2与过量H2反应,转移6NA个电子 | |
| C. | 1L1.0mo1/L的Na2SO4水溶液中含有的氧原子数为4NA | |
| D. | 1L0.1mol/L的氨水中有NA个NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com