一种将CO2变为燃料或有机化学品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2和CO2在一定条件下转化成CH4和H2O2。
已知:H2(g)+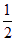 O2(g)=H2O(l) △H1=—285.8kJ/mol
O2(g)=H2O(l) △H1=—285.8kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=—889.6kJ/mol
H2O(l)=H2O(g) △H3=+44.0kJ/mol
(1)第③步反应的热化学方程式为 。W ww.k s5u.co m
| 
解析: (10分,每空2分) (1)CO2(g)+4H2(g)=CH4(g)+2H2O(l) △H=-253.6kJ/mol 或CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-165.6kJ/mol (2)5.6 (3)< Ka=Kt>Kb=Kd (4)HCOOH-2e-=CO2↑+2H+
练习册系列答案
相关习题
科目:高中化学
来源:
题型:阅读理解
(2012?天津模拟)为改善大气质量,国家拟于“十二五”期间,力争将CO 2变为燃料或有机化学产品的构想变为现实,将二氧化硫(SO 2)排放量减少8%,氮氧化物(NO x)排放量减少10%. I.一种将CO 2变为燃料或有机化学产品的构想分成3个步骤: ①利用浓碳酸钾溶液吸收空气中的CO 2; ②将第①步吸收液电解产生H 2和O 2,同时分离出CO 2; ③将第②步产生的H 2(g)和CO 2(g)在一定条件下转化成CH 4(g)和H 2O(l). 已知:H 2(g)+ O 2(g)=H 2O(l)△H 1=-285.8kJ/mol CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l)△H 2=-889.6kJ/mol 写出第③步反应的热化学方程式为 CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-253.6kJ/mol . II.目前,消除大气污染有多种方法. (1)处理NO x的一种方法是利用甲烷催化还原NO x.写出甲烷直接将NO 2还原得到无污染的产物的化学方程式 CH4+2NO2═N2+CO2+2H2O CH4+2NO2═N2+CO2+2H2O . (2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应: 2NO(g)+2CO(g)?N 2(g)+2CO 2(g);△H<0. 该反应的化学平衡常数表达式为K= . 在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图1所示. 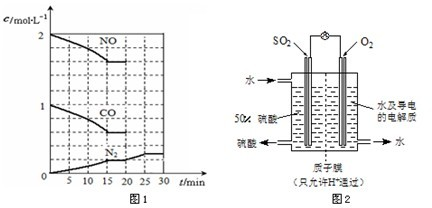 若保持温度不变,20min时再向容器中充入CO、N 2各0.6mol,平衡将 不 不 移动(填“向左”、“向右”或“不”). 若20min时改变反应条件,导致N 2浓度发生如图1所示的变化,则改变的条件可能是 ② ② (填序号). ①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO 2的量 (3)最近,某科研单位研制成功一种处理SO 2的方法:利用电化学原理将发电厂产生的大量SO 2制成硫酸,装置如图2,其电池反应方程式为:2SO 2+O 2+2H 2O=2H 2SO 4,该电池电动势为1.06V.实际过程中,将SO 2通入电池的 负 负 极(填“正”或“负”),负极反应式为 SO2-2e-+2H2O=4H++SO42- SO2-2e-+2H2O=4H++SO42- .用这种方法处理SO 2废气的优点是可回收大量有效能,副产品为H 2SO 4,减少环境污染.
查看答案和解析>>
科目:高中化学
来源:天津市十二区县重点学校2012届高三毕业班联考(二)化学试题
题型:058
为改善大气质量,国家拟于“十二五”期间,力争将CO2变为燃料或有机化学产品的构想变为现实,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.
Ⅰ.一种将CO2变为燃料或有机化学产品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2(g)和CO2(g)在一定条件下转化成CH4(g)和H2O(l).
已知:H2(g)+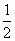 O2(g)=H2O(l) ΔH1=-285.8 kJ/mol O2(g)=H2O(l) ΔH1=-285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2=-889.6 kJ/mol
写出第③步反应的热化学方程式为________.
Ⅱ.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.写出甲烷直接将NO2还原得到无污染的产物的化学方程式________.
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)  N 2(g)+2CO 2(g);ΔH<0.
该反应的化学平衡常数表达式为K=________.
在一定温度下,将2 mol NO、1 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如下图所示.
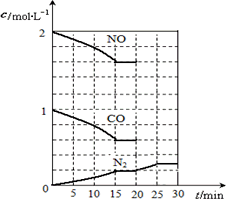
若保持温度不变,20 min时再向容器中充入CO、N2各0.6 mol,平衡将________移动(填“向左”、“向右”或“不”).
若20 min时改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件可能是________(填序号).
①加入催化剂
②降低温度
③缩小容器体积
④增加CO2的量
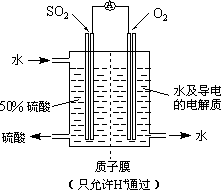
(3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如图,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06 V.实际过程中,将SO2通入电池的________极(填“正”或“负”),负极反应式为________.用这种方法处理SO2废气的优点是可回收大量有效能,副产品为H2SO4,减少环境污染.
查看答案和解析>>
科目:高中化学
来源:湖北省模拟题
题型:填空题
有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:
H2(g)+ 1/2O2(g)=H2O(l) △H1= -285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2= -889.6 kJ/mol
H2O(l)=H2O(g) △H3= +44.0 kJ/mol
(1)第③步反应的热化学方程式为______________________ 。并找出CO2的等电子体___________(一到二种)
(2)若在第②步电解吸收液时产生11.2LO2(标准状况下),则第③步中最多可制得______ L甲烷(标准状况下)
(3)为探究在密闭容器中进行第③步反应的最佳投料比,某研究小组向恒温(T1、T2均大于100℃)恒容容器中充入一定量的H2,在其他条件不变的情况下,改变起始CO2的物质的量测定达到平衡时CH4的体积分数,实验结果如图所示。则a、c两点处所的平衡状态中,氢气的转化率的大小关系是α(a)_______α(c)(填“>”“<”或“=”),a、b、c、d四点所处的平衡状态中,对应的平衡常数Ka、Kb、Kc、Kd的大小关系是__________________。 (4)H2和CO2在一定条件下也能转化成甲酸。甲酸,空气,质子交换膜和惰性电极组成的燃料电池工作时,负极反应物为_______发生的电极反应可表示为_____________。正极反应物为_________发生的电极反应可表示为______________。
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
为改善大气质量,国家拟于“十二五”期间,力争将CO2变为燃料或有机化学产品的构想变为现实,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。 I.目前,消除大气污染有多种方法。 (1)处理NOx的一种方法是利用甲烷催化还原NOx。写出甲烷直接将NO2还原得到无污染的产物的化学方程式 。 (2)降低汽车尾气的方法之一是在排气管上安装催化 转化器,发生如下反应: 2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。 N2(g)+2CO2(g);△H<0。 该反应的化学平衡常数表达式为K= 。 在一定温度下,将2molNO、1molCO充入1L  固定容积的容器中,反应过程中各物质的浓度变化 固定容积的容器中,反应过程中各物质的浓度变化
如下图所示。 若保持温度不变,20min时再向容器中充入 CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。 若20min时改变反应条件,导致N2浓度发生如右图所示的变化,则改变的条件可能 是 (填序号)。 ①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量  (3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如右图,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,写出负极反应式为 。用这种方法处理SO2废气的优点是可回收大量有效能,副产品为H2SO4,减少环境污染。 (3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如右图,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,写出负极反应式为 。用这种方法处理SO2废气的优点是可回收大量有效能,副产品为H2SO4,减少环境污染。
II.有人提出用碳酸钠溶液吸收发电厂废气中的二氧化硫。 已知:H2SO3的电离平衡常数为 K1=1.54×10-2 ,K2=1.O2×10-7 H2CO3的电离平衡常数为K1=4.31×l0-7 K2=5.61×10-11 (4)请写出向碳酸钠溶液中通入一定量的SO2生成无污染的二氧化碳气体的的化学方程式
查看答案和解析>>
| |

![]() O2(g)=H2O(l) △H1=—285.8kJ/mol
O2(g)=H2O(l) △H1=—285.8kJ/mol