
| A、用焰色反应鉴别NaCl、KCl和Na2SO4 |
| B、用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液 |
| C、利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 |
| D、用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如图:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述测定不能达到实验目的 |
| B、剩余的7.48g金属为铜 |
| C、共生成NO气体0.04mol |
| D、该合金中铜的质量分数为69.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯和丁烷 |
| B、丁烷和丁烯 |
| C、丙烷和丁烯 |
| D、丁烷和2-甲基丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 所选试剂 | 判别方法 | |
| 方法一 | 锌 | 取少量样品分别与锌反应,有气体产生的是稀盐酸,没有的是氯化钠溶液. |
| 方法二 | ||
| 方法三 |
查看答案和解析>>
科目:高中化学 来源: 题型:
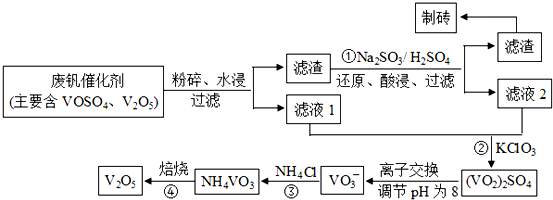
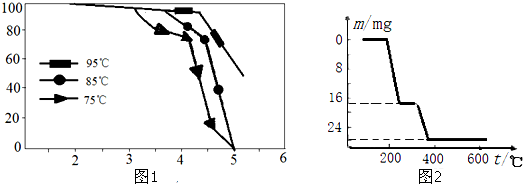
| 物质 | V2O5 | VOSO4 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 难溶 | 可溶 | 难溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液 | B、浓盐酸 |
| C、稀硝酸 | D、硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、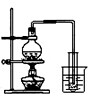 制取少量蒸馏水 |
B、 用铜和浓硝酸混合制取少量NO2 |
C、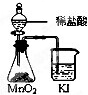 比较MnO2、Cl2、I2的氧化性 |
D、 探究NaHCO3的热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com