
【题目】同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是。
(2)溶液中通入Cl2时发生反应的化学方程式是,反应中Cl2表现出的性质是,此处的Cl2也可以用代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括、过滤、洗涤。
(4)用FeCl3溶液制备Fe2O3 , 可向FeCl3溶液中滴加足量 , 然后过滤、洗涤、 , 即可得到Fe2O3。
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是,反应一段时间后,取少量腐蚀液,向其中滴加 , 观察到 , 证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是。
【答案】
(1)固体部分溶解,溶液变为浅绿色,有气泡产生
(2)2FeCl2+Cl2=2FeCl3;氧化性;A
(3)降温结晶
(4)NaOH;溶液加热灼烧
(5)2Fe3++Cu =2Fe2++Cu2+KSCN;溶液;溶液变为红色;Fe3+、Fe2+、Cu2+
【解析】(1)根据金属活动顺序表,铁和盐酸反应,铜不与盐酸反应,发生反应:Fe+2H+=Fe2++H2↑,因此现象是固体部分溶解,溶液变为浅绿色,有气泡产生;
(2)利用氯气的氧化性,把Fe2+氧化成Fe3+ , 因此反应方程方式为2FeCl2+Cl2=2FeCl3;氯气的化合价降低,氯气作氧化剂,表现氧化性,A、H2O2具有强氧化性,能把Fe2+氧化成Fe3+ , 可以,故正确;B、SO2不能把Fe2+氧化成Fe3+ , 故错误;D、虽然浓硫酸具有强氧化性,能把Fe2+氧化成Fe3+ , 但引入SO42- , 故错误;
(3)产物带有结晶水,因此采用蒸发浓缩、冷却结晶、过滤方法得到FeCl3·6H2O;
(4)需要先把FeCl3转化成Fe(OH)3 , 然后再让Fe(OH)3分解成Fe2O3 , 因此先加入足量的NaOH或氨水等,然后2Fe(OH)3 ![]() Fe2O3+3H2O;
Fe2O3+3H2O;
(5)利用铜和Fe3+发生反应,即离子反应式Cu+2Fe3+=Cu2++2Fe2+;检验Fe3+一般采用KSCN溶液,如果溶液变红,说明含有Fe3+ , 根据离子反应方程式,溶液中还含有金属阳离子是Fe2+和Cu2+。
根据铁单质与酸的反应、亚铁离子和铁离子之间的相互转化等进行分析即可。


科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法不正确的是( ) 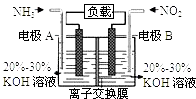
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3﹣6e﹣=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~J分别代表相关反应的一种物质,图中有部分生成物未标出.
已知:A分解得到等物质的量的B,C,D;反应①为:2Mg+CO2 ![]() 2MgO+C.
2MgO+C.
(1)A的化学式 .
(2)写出反应②的化学方程式: .
(3)写出反应③的离子方程式: .
(4)写出反应⑤的化学方程式: .
(5)在反应④中,当生成标准状况下2.24L G时,转移电子mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 氯化铵 | NaOH | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用离子方程式H++OH-=H2O表示的反应是
A. 稀醋酸和稀氨水反应 B. 稀硫酸和烧碱溶液反应
C. 稀盐酸和氢氧化铜反应 D. 稀硫酸和氢氧化钡溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com