
【题目】(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的 NO 和 NH3,在 一定条件下发生反应:6NO(g) + 4NH3(g)![]() 5N2(g) +6H2O(g)。
5N2(g) +6H2O(g)。
①能说明该反应已达到平衡状态的标志是 ___________
a.反应速率 v( NH3) =v( N2)
b.容器内压强不再随时间而发生变化
c.容器内 N2 的物质的量分数不再随时间而发生变化
d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6
e.12molN-H 键断裂的同时生成 5mol N≡N 键
f.混合气体的总质量不随时间的变化而变化
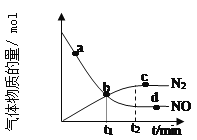
②某次实验中测得容器内 NO 及 N2 的物质的量随时间变化如图所示,图中 b 点 对应的速率关系是v(正) ___________ v(逆)(填﹥、﹤或﹦),d 点对应的速率关系是v(正) ___________ v(逆)
(填﹥、﹤或﹦)。
(2)298 K 时,若已知生成标准状况下 2.24LNH3时放出热量为 4.62kJ。写出合成氨反应的热化学方程式___________。在该温度下,取 1molN2和 3mol H2 放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于 92.4 kJ, 其原因是___________。
(3)一定条件下,在 2L密闭容器内,反应 2NO2(g)![]() N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
N2O4(g) ΔH=-180 kJ·mol-1,n(NO2)随时间变化如下表:
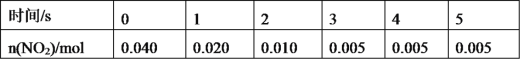
①用 N2O4 表示 0~2 s 内该反应的平均速率为__________。在第 5s 时,NO2 的转化 率为____________。(转化率是指某一反应物转化的百分率。)
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是______________。
【答案】bc > = N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol 该反应是可逆反应,1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ 0.00375molL-1s-1 87.5% 随着反应的进行,二氧化氮的物质的量浓度减小,反应速率减小
【解析】
(1)①根据化学平衡状态的特征分析判断;②根据图象,结合化学平衡的建立和达到平衡时ν(正)与ν(逆)相等判断。
(2)每生成2.24L氨气,同时放出4.62kJ的热量,据此计算生成2mol氨气放出的热量,在写出热化学方程式,结合可逆反应的特征分析解答;
(3)结合v=![]() 结合化学反应速率之比等于化学计量数之比计算反应速率,并根据浓度对反应速率的影响分析解答。
结合化学反应速率之比等于化学计量数之比计算反应速率,并根据浓度对反应速率的影响分析解答。
(1)①a.该反应达到平衡状态时,5v(NH3)正=4v(N2)逆,v( NH3) =v( N2),不能判断正逆反应速率的关系,故a错误;b.该反应是一个反应前后气体体积增大的可逆反应,当反应达到平衡状态时,容器内压强不随时间的变化而变化,所以能判断反应是否达到平衡状态,故b正确;c.容器内N2的物质的量分数不再随时间而发生变化,说明N2浓度不再改变,能判断达到平衡状态,故c正确;d.容器内 n(NO)∶n(NH3)∶n(N2)∶n(H2O) = 6∶4∶5∶6,不能说明浓度是否发生变化,不能判断达到平衡状态,故d错误;e.12molN-H 键断裂的同时一定会生成 5mol N≡N 键,都表示正反应速率,不能判断达到平衡状态,故e错误;f.反应前后都是气体,混合气体的总质量始终不变,混合气体的总质量不随时间的变化而变化,不能判断达到平衡状态,故f错误;故答案为:bc;
②图中b点没有达到平衡,反应仍在正向进行,所以图中b点对应的速率关系是v(正)>v(逆);d点达到平衡状态,ν(正)=ν(逆)相等,故答案为:>;=;
(2) 标准状况下,2.24LNH3的物质的量=![]() =0.1mol,放出4.62kJ的热量,则生成2mol氨气放热
=0.1mol,放出4.62kJ的热量,则生成2mol氨气放热![]() ×4.62kJ=92.4kJ,反应的热化学方程式为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol,合成氨的反应是可逆反应,△H=-92.4kJ/mol是1molN2和3molH2完全反应放出的热量,因此将1molN2和3molH2在此条件下反应,放出的热量一定小于92.4kJ,故答案为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol;该反应是可逆反应,1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ;
×4.62kJ=92.4kJ,反应的热化学方程式为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol,合成氨的反应是可逆反应,△H=-92.4kJ/mol是1molN2和3molH2完全反应放出的热量,因此将1molN2和3molH2在此条件下反应,放出的热量一定小于92.4kJ,故答案为:N2(g)+3H2(g)2NH3(g) △H=-92.4kJ/mol;该反应是可逆反应,1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ;
(3)①用NO2表示0~2s内该反应的平均速度为 =0.0075molL-1s-1;则用 N2O4 表示 0~2 s 内该反应的平均速率为
=0.0075molL-1s-1;则用 N2O4 表示 0~2 s 内该反应的平均速率为![]() ×0.0075molL-1s-1=0.00375molL-1s-1,在第5s时,NO2的转化率为
×0.0075molL-1s-1=0.00375molL-1s-1,在第5s时,NO2的转化率为![]() ×100%=87.5%,故答案为:0.00375molL-1s-1;87.5%;
×100%=87.5%,故答案为:0.00375molL-1s-1;87.5%;
②根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是随着反应的进行,二氧化氮的物质的量浓度减小,反应速率减小,故答案为:随着反应的进行,二氧化氮的物质的量浓度减小,反应速率减小。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol有机物X最多能与1 mol HCl发生加成反应得到Y,1 mol Y能与4 mol Cl2在一定条件下发生取代反应得到Z。已知Y分子中的碳碳键都是单键,Z分子中没有氢原子,则X的结构简式可能是( )
A.![]() B.CH≡CH
B.CH≡CH
C.![]() D.CH≡CCH3
D.CH≡CCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列5种有机物:
① HCOOCH3 ② CH3COOH ③ CH3—CH=CH2 ④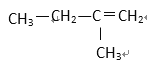 ⑤
⑤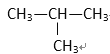
(1) 其中符合通式CnH2n+2的是________ ( 填序号,下同 ), 与 ①互为同分异构体的是_________,与 ③ 互为同系物的是___________
(2) 用系统命名法给 ⑤ 命名,其名称为 _________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用光伏电池提供电能处理废水中的污染物(有机酸阴离子用R-表示),并回收有机酸HR,装置如图所示。下列说法错误的是

A.在光伏电池中a极为正极B.石墨(2)极附近溶液的pH降低
C.HR溶液:c2<c1D.若两极共收集3mol气体,则理论上转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备,符合工业生产实际的是![]()
A.工业上炼铁时,常用石灰石除去铁矿石中的![]()
B.工业上用接触法制硫酸,在接触室里制出硫酸
C.工业上用二氧化硅在高温下与焦炭反应制得高纯度的硅
D.工业上主要从海水中提取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验的描述中,下列叙述正确的是( )
①钠放入水中后,沉在水下缓缓冒出气体
②Na2CO3和NaHCO3的溶液都可以使无色酚酞试液变红
③将某气体通入品红溶液中,红色褪去,说明该气体一定是SO2
④向某溶液中加入烧碱溶液,加热后生成使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
⑤除去NaCl中混有的少量KNO3采用蒸发结晶,趁热过滤的方法。
A.①④⑤B.②④⑤C.②③④D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )
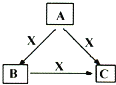
A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com