
| V | 10 |
| 1 |
| 2 |
100×
| ||
| M |
| 100(cV-10c′V′)×10-3 |
| 2M |
| 100(cV-10c′V′)×10-3 |
| 2M |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| V | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:查看答案和解析>>
科目:高中化学 来源:2010年海南省海口市高三下学期高考调研(一)化学试题 题型:实验题
(9分)为测定碳酸钙纯度(设所含杂质为SiO2),同学们设计了如下两个实验方案:
【方案I】
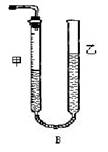
(1)组装发生并测定生成气体体积的实验装置,并检验气密性;
(2)称取碳酸钙样品W g;
(3)加入过量盐酸;
(4)收集并测定生成的气体体积V mL。
问题I—1:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸
钙的纯度会 (填“偏高、偏低、无影响”)。
问题I—2:在方框中画出测定生成的气体体积的装置简图。

【方案II】
(1)称取碳酸钙样品Wg;
(2)在锥形瓶中用C mol/L盐酸V mL(过量)溶解样品;
(3)加入甲基橙作指示剂,再用浓度为C1 mol/L的标准氢氧化钠溶液滴定过量的盐酸,用去氢氧化钠溶液V1毫升。(已知甲基橙的变色范围是pH=3.1~4.4)
问题II—1:未滤去不溶物SiO2,对测定结果是否有影响?(填有或无) ;
理由是 。
问题II—2:碳酸钙纯度表达式 。
【方案评价】
你认为以上两个方案中,最好的方案是 ,
另一个方案不够好的理由是 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省高三10月月考化学试题 题型:实验题
(16分)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案。请回答每个方案中提出的问题。
【方案I】
(1)称取碳酸钙样品 M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题1:反应结束后,量气管中的显示如右图所示,接下来的操作是: ,读出甲管中液面的读数。
【方案II】
(1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液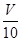 mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
mL,以酚酞作指示剂,用c′ mol/L NaOH溶液滴定,恰好用去V′mL。
问题2:列出本实验中所用到的主要仪器名称(除铁架台及附件、烧杯之外) 。
问题3:碳酸钙纯度计算公式 。
问题4:当碳酸钙溶解完全后,少量未溶的SiO2没过滤去,结果得到碳酸钙纯度________ (偏大、偏小或无影响)
【方案Ⅲ】
(1)称取碳酸钙样品 M g;
(2)加入足量c mol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量c′ mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题5:此方案中不需要的数据是 (填选项编号)。
A.c、V B.c′、 V′ C. M′ D. M
问题6:为减少实验误差,步骤(3)、(5)过滤后都要对沉淀进行洗涤,如果步骤(3)未经洗涤,则测定的碳酸钙的纯度将 (偏大、偏小、无影响,下同);如果步骤(5)未经洗涤,则测定的碳酸钙纯度将 。
问题7:判断步骤(4)中Na2CO3溶液是否过量的方法是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com