
| 4.6% |
| 55 |
| 46.86% |
| 56 |
| 4.6% |
| 55 |
| 46.86% |
| 56 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
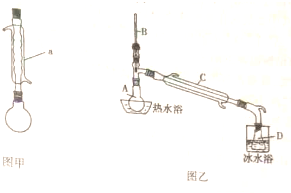
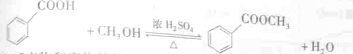
| 沸点/°C | 密度/g?cmˉ3 | 水中溶解性 | |
| 苯甲酸 | 249 | 1.2659 | 微溶于水 |
| 甲醇 | 64.6 | 0.7910 | 易溶于水 |
| 苯甲酸甲酯 | 198 | 1.0900 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.8 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管用蒸馏水洗净后,必须用已知浓度的盐酸润洗 |
| B、锥形瓶用蒸馏水洗净后,用NaOH溶液润洗后再加入待测液 |
| C、滴定时,必须逐出滴定管下口的气泡 |
| D、读数时,视线与滴定管内液体的凹液面最低处保持水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:
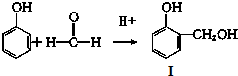
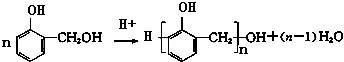
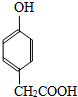 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2在反应中是还原剂 |
| B、每摩尔Na2O2完全反应时转移电子1mol |
| C、反应中O2既是氧化产物,又是还原产物 |
| D、上述反应可用于潜水艇中提供氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定 次数 | 待测混合溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 27.46 | 25.90 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com