
【题目】工业上常用CO和H2合成甲醇,反应方程式为:
CO (g) +2H2 (g) ![]() CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图所示。
CH3OH (g) △H,在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,达到平衡时CH3OH的体积分数(V%)与n(H2):n(CO)的关系如图所示。

(1)当起始n (H2):n(CO) =2,经过5min达到平衡,此时容器的压强是初始压强的0.7倍,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入0.15 mol CO (g)和0.05 mol CH3OH (g),达新平衡时H2的转化率将_______(选填“增大”、“减小”或“不变”)。
(2)由下图可知该反应的△H_____0(选填“>”、“<”或“=”,下同),压强pl____p2;当压强为p2时,在y点:v(正)____v(逆)。

【答案】0.09molL-1min-1增大>>>
【解析】
(1)H2和CO总物质的量为3mol,n(H2):n(CO)=2,起始时n(H2)=2mol,n(CO)=1mol,
CO (g) +2H2 (g) ![]() CH3OH (g)
CH3OH (g)
起始: 1 2 0
变化: x 2x x
平衡: 1-x 2-2x x 相同条件下,压强之比等于物质的量之比,即3/(3-2x)=1/0.7,解得2x=0.9mol,根据化学反应速率数学表达式,v(H2)=0.9/(2×5)mol/(L·min)=0.09mol/(L·min);达到平衡时,平衡常数K=![]() =
= =2.70,再充入0.15molCO和0.05molCH3OH,各组分的物质的量分别为0.7mol、1.1mol、0.5mol,此时的Q=2.36<2.70,反应正向移动,H2的转化率增大;
=2.70,再充入0.15molCO和0.05molCH3OH,各组分的物质的量分别为0.7mol、1.1mol、0.5mol,此时的Q=2.36<2.70,反应正向移动,H2的转化率增大;
(2)根据图像,随着温度升高,CO的转化率增大,平衡向正反应方向进行,即△H>0;作等温线,增大压强,平衡向正反应方向进行,CO的转化率增大,即p1>p2;y点在T温度下没有达到平衡,在y点反应向正反应方向移动,即v(正)>v(逆)。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】114号元素为Fl(中文名“![]() ”),它是主族元素,其原子核外最外层电子数是4。下列说法不正确的是
”),它是主族元素,其原子核外最外层电子数是4。下列说法不正确的是
A. Fl的原子核外有114个电子 B. Fl是第七周期第IVA族元素
C. Fl在同主族元素中金属性最强 D. Fl的原子半径小于同主族其他元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废治废、变废为宝可以实现资源的综合利用。用废铁块、废盐酸可以生产净水剂聚合氯化铁和高铁酸钠,转化关系如图所示:
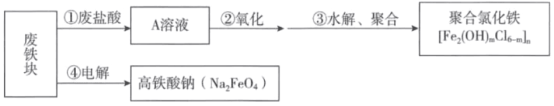
(1)A溶液中一定含有的溶质是_______。
(2)若使③中水解程度变大,可采取的措施是_______(填字母序号)。
a.加热 b.加入NaHCO3 c.加入NH4Cl
(3)写出③中水解生成Fe2(OH) m Cl6-m反应的化学方程式:______。
(4)将废铁块进行预处理制成电极,通过电解制备高铁酸钠,该装置原理示意图如图所示。铁块做_______(填“阳极”或“阴极”),对应的电极反应式为_______。
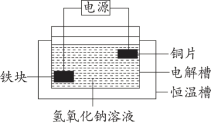
(5)高铁酸钠在水中缓慢产生红褐色沉淀和一种气体,该反应的离子方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)可逆反应A(g)+B(g)2C(g)在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.

①由T1向T2变化时,正反应速率________逆反应速率(填“>”、“<”或“=”).
②由T3向T4变化时,正反应速率________逆反应速率(填“>”、“<”或“=”).
③反应在________温度下达到平衡.
④此反应的正反应为________热反应.
(2)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

①图中表示NO2变化的曲线是________ ,用O2表示从0~2s内该反应的平均速率v=________ .
②能说明该反应已经达到平衡状态的是________
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解絮凝净水可用如图装置模拟探究,下列叙述正确的是
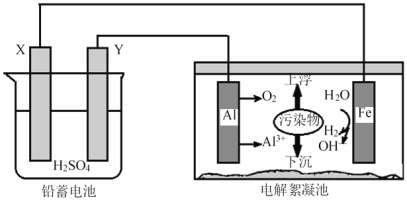
A. 电子从X极经电解液流入Y极
B. 铝电极表面的反应有:Al -3e-=Al3+,4OH--4e-=O2↑+2H2O
C. Y的电极反应:Pb-2e-+SO42- = PbSO4
D. 电路每通过2mol电子,理论上电解池阴极上有22.4 L H2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O。

(1)甲池是______装置;
(2)乙池中A(石墨)电极的名称是______;
(3)写出通入CH3OH的电极的电极反应式:______;
(4)乙池中反应的化学方程式为______;
(5)当乙池中B(Ag)极的质量增加4.32g时,此时丙池某电极上析出1.60g某金属,则丙池中的某盐溶液可能是 ______(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,甲为0.1mol/L的醋酸溶液,乙为0.5mol/L的醋酸溶液。下列说法正确的是
A. 溶液的导电能力:甲=乙 B. 醋酸的电离转化率:甲 >乙
C. 对水的电离的抑制程度:甲 >乙 D. c(CH3COO-):甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,把0.5mol/L的HF溶液加水稀释,随着加水量的增大,下列判断正确的是
A. 溶液中F-的个数减小 B. 电离平衡常数ka值变大
C. 电离转化率不变 D. c(F- )/c(HF)此比值增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com