
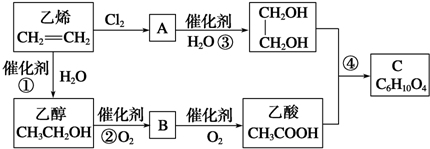
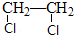
分析 乙烯与溴发生加成反应生成A为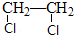 ,A发生水解得乙二醇,乙烯与水发生加成得乙醇,乙醇催化氧化得B为CH3CHO,B氧化得乙酸,根据C的分子式可知,乙酸与乙二醇发生酯化反应得C为CH3COOCH2CH2OOCCH3,据此答题.
,A发生水解得乙二醇,乙烯与水发生加成得乙醇,乙醇催化氧化得B为CH3CHO,B氧化得乙酸,根据C的分子式可知,乙酸与乙二醇发生酯化反应得C为CH3COOCH2CH2OOCCH3,据此答题.
解答 解:乙烯与溴发生加成反应生成A为 ,A发生水解得乙二醇,乙烯与水发生加成得乙醇,乙醇催化氧化得B为CH3CHO,B氧化得乙酸,根据C的分子式可知,乙酸与乙二醇发生酯化反应得C为CH3COOCH2CH2OOCCH3,
,A发生水解得乙二醇,乙烯与水发生加成得乙醇,乙醇催化氧化得B为CH3CHO,B氧化得乙酸,根据C的分子式可知,乙酸与乙二醇发生酯化反应得C为CH3COOCH2CH2OOCCH3,
(1)根据上面的分析可知,A的结构简式为: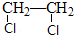 ,
,
故答案为: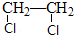 ;
;
(2)乙酸分子中的官能团名称是羧基,鉴别乙醇和乙酸可以用碳酸氢钠溶液或石蕊试液,
故答案为:羧基;碳酸氢钠溶液或石蕊试液;
(3)反应①为乙烯与水发生加成反应生成乙醇,反应方程式为CH2=CH2+H2O$\stackrel{催化剂}{→}$ CH3CH2OH,是加成反应,反应②为乙醇催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$\frac{\underline{催化剂}}{△}$2CH3CHO+2H2O,是氧化反应,反应④为乙二醇与乙酸发生酯化反应生成C,由C的分子式可知,应是1分子乙二醇与2分子乙酸反应,则C为二乙酸乙二酯(CH3COOCH2CH2OOCCH3),反应方程式为:2CH3COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O,是酯化反应,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$ CH3CH2OH;加成反应;2CH3CH2OH+O2$\frac{\underline{催化剂}}{△}$2CH3CHO+2H2O;氧化反应;2CH3COOH+HOCH2-CH2OH$→_{△}^{浓硫酸}$CH3COOCH2-CH2OOCCH3+2H2O;酯化反应.
点评 本题考查有机物的推断与合成,难度中等,在注重对学生基础知识巩固的同时,培养学生的知识的迁移能力,记住常见官能团的结构、性质以及官能团之间的相互转化是关键,注意合成路线中碳原子数目的变化.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2与0.5 molO2反应放出的热就是H2的燃烧热 | |
| B. | 1 mol H2SO4与1 molBa(OH)2反应时放出的热叫做中和热 | |
| C. | 热化学方程式中的化学计量数表示物质的量,可以是分数 | |
| D. | △H>0表示放热反应,△H<0 表示吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.1mol羟基中含有1 mol电子 | |
| B. | 乙烷和丙烯任意比混合的气体1mol,完成燃烧均生成3molH2O | |
| C. | CH2Cl2具有两种同分异构体 | |
| D. | 图中有机物(1-甲基环己烷)的一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | B烧杯中加一定量的KCl固体可使溶液恢复原状 | |
| B. | c电极周围溶液变红 | |
| C. | A烧杯内Cu2+浓度降低 | |
| D. | d电极上可以析出使湿润的淀粉KI试纸变蓝的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度 | B. | 加入适量的水 | ||
| C. | 加入少量CuSO4溶液 | D. | 加入浓度较大的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者都能水解,但水解的最终产物不同 | |
| B. | 二者都属于糖类,且都是高分子化合物 | |
| C. | 二者含C、H、O三种元素的质量分数相同,且二者互为同分异构体 | |
| D. | 二者的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com