
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: 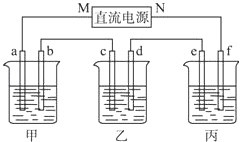
(1)电源的N端为极.
(2)电极b上发生的电极反应为 .
(3)列式计算电极b上生成的气体在标准状况下的体积 .
(4)电极c的质量变化是g.
【答案】
(1)正
(2)4OH﹣﹣4e﹣=2H2O+O2↑
(3)2.8L
(4)16
【解析】解:(1.)乙杯中c质量增加,说明Cu沉积在c电极上,电子是从b﹣c移动,M是负极,N为正极,所以答案是:正;
(2.)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH﹣放电,即4OH﹣﹣4e﹣=2H2O+O2↑,所以答案是:4OH﹣﹣4e﹣=2H2O+O2↑;
(3.)丙中为K2SO4 , 相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100﹣x)×10.47%,得x=4.5g,故为0.25mol.由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则生成O2为0.5mol× ![]() =0.125mol,标况下的体积为0.125×22.4=2.8L,所以答案是:2.8L.
=0.125mol,标况下的体积为0.125×22.4=2.8L,所以答案是:2.8L.
(4.)整个电路是串联的,所以每个烧杯中的电极上转移电子数是相等的,根据电极反应:Cu2++2e﹣=Cu,可知转移0.5mol电子生成的m(Cu)= ![]() ×64g/mol=16g.所以答案是:16.
×64g/mol=16g.所以答案是:16.


科目:高中化学 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验室测定化合物X的组成实验如下:下列说法不正确的是

A. 固体2是氧化铁
B. X与足量的热浓硝酸反应可能有NO2和CO2生成
C. 溶液甲中可能含有Fe3+
D. X的化学式可以表示为Fe3C2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A.A的转化率变大
B.平衡向正反应方向移动
C.D的体积分数变大
D.a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)CO(g)+H2 (g)△H=+131.3kJmol﹣1
(1)该反应的平衡常数K随温度的升高而(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡(向左移/向右移/不移动).
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有(填序号).
A.单位体积内每消耗1mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)某温度下,将4.0mol H2O(g)和足量的炭充入2L的密闭容器中,发生如下反应,C(s)+H2O(g)CO (g)+H2 (g),达到平衡时测得K=1,则此温度下H2O(g)的转化率为
(5)己知:①C (s)+H2O(l)CO (g)+H2 (g)△H1
②2CO(g)+O2(g)═2CO2(g)△H 2
③H2O(l)═H2(g)+ ![]() O2(g)△H 3
O2(g)△H 3
则2C(s)+2O2(g)═2CO2(g)的△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H—离子可以跟NH3反应:H— + NH3 = NH2— + H2,根据该反应事实,正确结论是
A. NH3具有还原性 B. H—是很强的氧化剂
C. H2既是氧化产物又是还原产物 D. 该反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示有机化合物的性质说法不正确的是( ) 
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1 mol 该化合物最多可以与3 mol NaOH反应
C.既能催化加氢,又能使酸性KMnO4溶液褪色
D.既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列各问:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性.
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
(3)①在50mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.20.16L B.6.72L C.10.08L D.15.12L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:

(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是___________。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是_________________,说明该反应属于_________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在甲中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是________________;
②若观察到烧杯里产生气泡,则说明M溶于水____________(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是______。
(4)至少有两种实验方法能证明超氧化钾与水的反应(4KO2+2H2O = 4KOH+3O2↑)是放热反应还是吸热反应。
方法(1):选择上述装置________(填“Ⅰ”“Ⅱ”或“Ⅲ”)进行实验;
方法(2):取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到棉花燃烧,则说明该反应是_____________反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com