
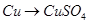
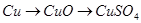
科目:高中化学 来源:不详 题型:填空题
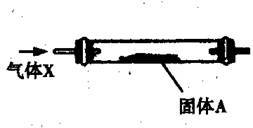
| A.固体A为无水硫酸铜时,可以检验气体X中是否含有水蒸气 |
| B.固体A为铜时,可以除去N2中的O2 |
| C.在空气流作用下,加热氯化铁晶体得到纯净的无水氯化铁 |
| D.将氨气和空气混合气通过灼热的铂丝,可看到有红棕色气体生成 |
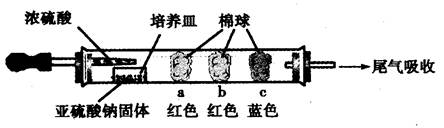
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 结论:该气体具有 性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
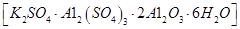 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下: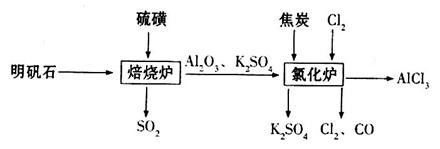
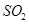 的方法是________________________________。
的方法是________________________________。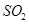 ,下列装置合理的是________(填代号)。
,下列装置合理的是________(填代号)。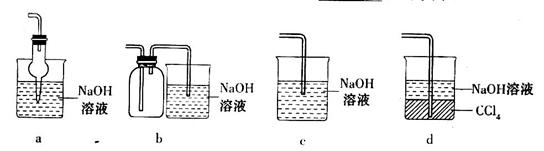
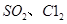 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)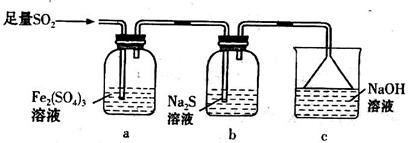
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.温室效应 | B.酸雨 | C.粉尘污染 | D.水体富营养化 |
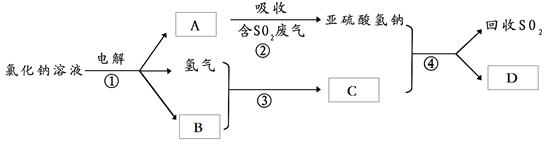 工业生产中,步骤③的反应条件为 。
工业生产中,步骤③的反应条件为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
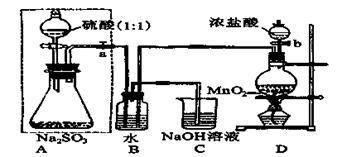
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
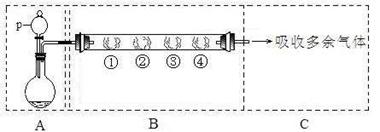
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 碘水(黄色) |
| 现象 | | 褪色 | |
| 体现SO2的性质 | 水溶液显酸性 | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeS和CuS | B.CuS | C.CuS和S | D.Al2S3、FeS和CuS |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸能与灼热的木炭反应,生成二氧化碳和二氧化硫 |
| B.浓硫酸具有吸水性,在实验室中常用作干燥剂 |
| C.常温下,可以用铁质或铝质容器储存浓硫酸或浓硝酸 |
| D.浓硫酸与铜反应产生的气体对环境无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com