
选考(13分)(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①1mol PAN中含有的σ键数目为____。PAN中四种元素的第一电离能由大到小的顺序为__________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________,
心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是___________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键
b.共价键
c.配位键
d.范德华力
e.氢键
②NH4NO3中阳离子的空间构型为_____,阴离子的中心原子轨道采用_______杂化。
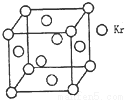
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
(1)①10NA(或6.02×1024)(1分);N>O>C>H(2分)
②6(1分);1s22s22p63s23p63d6(或[Ar] 3d6)
(1分 ③高(1分);HCOOH分子间能形成氢键(1分)
(2)①de(2分) ②正四面体形(1分);sp2 (1分) (3)3(2分)
【解析】
试题分析:(1)①单键都是σ键,双键是由1个σ键和1个 组成的,则根据PAN的结构简式可知1mol PAN中含有的σ键数目为10NA(或6.02×1024)。非金属性越强第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,因此PAN中四种元素的第一电离能由大到小的顺序为N>O>C>H。
组成的,则根据PAN的结构简式可知1mol PAN中含有的σ键数目为10NA(或6.02×1024)。非金属性越强第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,因此PAN中四种元素的第一电离能由大到小的顺序为N>O>C>H。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,其中NO和水是配体,则该配合物中中心离子的配位数为6;亚铁离子核外电子数是24个,则根据核外电子排布规律可知中心离子的核外电子排布式为1s22s22p63s23p63d6(或[Ar] 3d6)。
③由于HCOOH分子间能形成氢键,二甲醚中不存在氢键,因此相同压强下,HCOOH的沸点比CH3OCH3高。
(2)①(NH4)2SO4是离子化合物,存在离子键、共价键,另外氮元素与氢元素之间还有配位键,则晶体中各种微粒间的作用力不涉及的是范德华力和氢键,答案选de。
②NH4NO3中阳离子是铵根,氮元素不存在孤对电子,价层电子对数是4,则空间构型为正四面体形;阴离子是硝酸根,其中氮元素也不存在孤对电子,其价层电子对数是3,所以中心原子轨道采用sp2杂化。
(3)根据Kr晶体的晶胞结构图可知,晶体中以顶点为中心,与每个Kr原子紧相邻的Kr原子有 个,即m=12.晶胞中Kr原子为n个,则n=
个,即m=12.晶胞中Kr原子为n个,则n= ,所以m/n=3。
,所以m/n=3。
考点:考查化学键、第一电离能、氢键、分子空间构型、杂化轨道以及晶胞计算等


科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:填空题
【选修3—物质结构与性质】(14分)
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道。请回答下列问题:
(1)R原子的基态电子排布式为 。
(2)X、Y原子的第一电离能大小顺序为 。(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为 。
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为 ,中心原子的杂化轨道类型为 。
(5)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示。

则该矿物的化学式为 ,若已知该晶胞的边长为a cm,则该晶胞的密度为 g/cm3。(用含a、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
向含S2—、Fe2+、Br—、I—各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是 :

查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省部分普高高三2月联考化学试卷(解析版) 题型:选择题
欲证明一瓶无色液体是纯水,可靠的实验方法是:
A.测得其pH=7
B.电解时得到H2与O2的体积比为2:1
C.遇钠生成氢气
D.1.01× 105Pa时沸点为100℃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三第六次月考理综化学试卷(解析版) 题型:选择题
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知: 3I2+6OH—==IO3—+5I—+3H2O,下列说法不正确的是

A.右侧发生的电极方程式:2H2O+2e—==H2↑+2OH—
B.电解结束时,右侧溶液中含有IO3—
C.电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:实验题
(14分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:实验原理是
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C. 将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
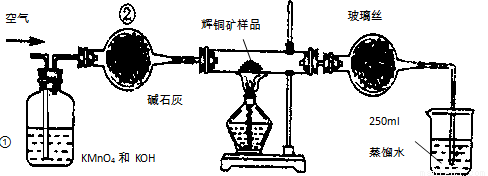
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是__________(写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6.25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1.0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
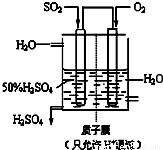
(6)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期期末考试化学试卷(解析版) 题型:选择题
有关AgCl沉淀的溶解平衡说法正确的是
A.此时,AgCl沉淀溶解速率为零
B.AgCl难溶于水,溶液中没有Ag+ 和Cl—
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方程式中属于水解反应的是
A.HCO3-+H2O 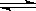 H3O++CO32- B.HCO3-+H2O
H3O++CO32- B.HCO3-+H2O 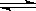 OH-+H2CO3
OH-+H2CO3
C.NH3+H2O 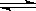 NH4++OH- D.HCO3-+OH- == CO32-+H2O
NH4++OH- D.HCO3-+OH- == CO32-+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com