
| A. | 常温下,2NO(g)+O2(g)═2NO2(g)能够自发进行,则该反应的△H<0 | |
| B. | 反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 | |
| C. | 同温、同浓度的硫酸和氢氧化钠稀溶液中,水的电离程度相同 | |
| D. | 硫酸工业中二氧化硫的催化氧化,不采用高压是因为压强对SO2转化率无影响 |
分析 A、根据△H-T△S<0反应自发进行判断;
B、反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正逆反应都加快;
C、同温、同浓度的硫酸和氢氧化钠稀溶液中,硫酸是二元酸,同浓度硫酸和氢氧化钠溶液中氢离子的浓度大于氢氧根离子的浓度,所以氢氧化钠溶液中水的电离程度大;
D、压强对化学反应前后气体体积变化的反应的平衡移动有影响.
解答 解:A、常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,说明△H-T△S<0,已知该反应△S<0,所以该反应的△H<0,故A正确;
B、反应N2(g)+3H2(g)?2NH3(g),其他条件不变时充入N2,正逆反应都加快,故B错误;
C、同温、同浓度的硫酸和氢氧化钠稀溶液中,硫酸是二元酸,同浓度硫酸和氢氧化钠溶液中氢离子的浓度大于氢氧根离子的浓度,所以氢氧化钠溶液中水的电离程度大,两者水的电离程度不同,故C错误;
D、二氧化硫的催化氧化不采用高压是考虑设备的耐压程度,压强对化学平衡会产生影响,增大压强,有利于二氧化硫的转化,故D错误;
故选A.
点评 本题目综合考查学生反应的自发性、外界条件对化学反应速率的影响及化学平衡的影响因素等知识,属于综合知识的考查,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:l | B. | 1:2 | C. | 3:2 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③ | C. | 全部 | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .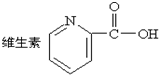 中的含氧官能团的名称是:羧基 中的含氧官能团的名称是:羧基 | |
| B. | 分子式为C4H8的烃中一定含有官能团碳碳双键 | |
| C. | 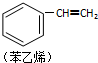 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) 1 mol苯乙烯(如图)中含有的C═C键数为4NA(NA为阿伏加德罗常数) | |
| D. | 丙烯的结构简式可以表示为:CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在船舶的外壳装上镁合金或锌块保护钢铁设备被称为牺牲阳极的阴极保护法 | |
| B. | 赤潮、白色污染、绿色食品中的“赤”“白”“绿”均指相关物质的颜色 | |
| C. | 海水淡化的方法主要有:蒸馏法、电渗析法、离子交换法等 | |
| D. | 乙烯的产量可以用来衡量一个国家的石油化工发展水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2溶液 | B. | 浓的CaCl2溶液 | C. | Ba(NO3)2溶液 | D. | H2S的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
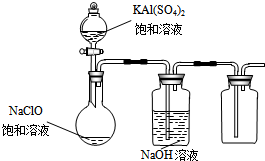 NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的氢化物和E的氢化物能相互反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 金属D能在A的最高价氧化物中燃烧,生成A的化合物 | |
| D. | E单质的水溶液使紫色石蕊试液先变红后褪色,说明E单质具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com