


科目:高中化学 来源: 题型:
| A、盐酸中滴加氨水至中性,溶质为氯化铵 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C、饱和石灰水中加入少量CaO,恢复至原温后溶液的pH值不变 |
| D、向沸水中滴加适量饱和FeCl3溶液,可制得红褐色带电的胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、微量元素虽然含量占人体的0.01%以下,但对于维持生命活动,促进健康和发育却有极其重要的作用 |
| B、锌元素属于微量元素 |
| C、青少年或成人缺碘可引起甲状腺肿 |
| D、铁是人体必需微量元素中含量最多的一种,因此摄入的铁越多越利于身体健康 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当n=2时,物质A、B的转化率之比为1:2 | ||
B、起始时刻和达到平衡后容器中的压强比为(1+n):(1+n-
| ||
| C、当v(A)正=2v(C)逆时,可断定反应达到平衡 | ||
| D、若起始时放入3molA和3n molB,则达到平衡时生成3a mol的C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两溶液溶质物质的量浓度相同 |
| B、用同浓度的盐酸中和时,消耗盐酸的体积相同 |
| C、两溶液中OH-离子浓度相同 |
| D、加入等体积的水稀释后,它们的pH仍相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>c>b | B、b>c>a |
| C、a=b=c | D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
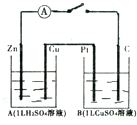 如图装置闭合电键时,电流计A的指针将发生偏转,试回答下列问题.
如图装置闭合电键时,电流计A的指针将发生偏转,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
A、苯酚与碳酸钠溶液的反应 |
| B、等体积、等浓度的Ca(HCO3)2和NaOH溶液混合Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H20 |
| C、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| D、淀粉碘化钾溶液在空气中变蓝2I-+O2+H2O=I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加KSCN溶液 | 固体物质中有FeCl3 | |
| 在KMnO4溶液中加少量A溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com