
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑤ | ⑦ | ⑨ | |||||
| 第3周期 | ① | ③ | ⑥ | ④ | ⑧ | ⑩ | ||
| 第4周期 | ② |
分析 由元素在周期表中位置,可知①为Na、②为K、③为Al、④为S、⑤为N、⑥为P、⑦为O、⑧为Cl、⑨为F、⑩为Ar.
(1)稀有气体的化学性质最不活泼;同周期自左而右电负性增大、同主族自上而下电负性减小,电负性越大得电子能力越强;同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(2)K的金属性最强,故氢氧化钾的碱性最强,③的最高价氧化物的水化物为氢氧化铝,二者反应生成偏铝酸钾与水;
(3)元素非金属性越强,氢化物越还原性越弱;
(4)⑤、⑧的氢化物分别为 NH3、HCl,相互反应产生白色固体为NH4Cl,对该固体中阳离子为NH4+,可与碱反应生成碱性气体NH3,再利用湿润的红色石蕊试纸碱性检验;
(5)两种均含①④⑦和氢元素四种元素的化合物相互反应,是亚硫酸氢钠与硫酸氢钠反应生成硫酸钠、二氧化硫与水;
(6)元素⑤的最高价含氧酸为HNO3,反应中硝酸起氧化剂与酸的作用,NO3-减少2×10-3mol,说明起氧化剂作用的硝酸为2×10-3mol,根据Cu元素守恒计算硝酸铜的物质的量,再根据硝酸根守恒计算起酸性作用的硝酸,溶液中减少的氢离子的物质的量等于参加反应硝酸的物质的量.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Al、④为S、⑤为N、⑥为P、⑦为O、⑧为Cl、⑨为F、⑩为Ar.
(1)稀有气体的Ar化学性质最不活泼;同周期自左而右电负性增大、同主族自上而下电负性减小,电负性越大得电子能力越强,故F元素得电子能力最强;同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Al>N>O,
故答案为:Ar;F;Na>Al>N>O;
(2)K的金属性最强,故氢氧化钾的碱性最强,③的最高价氧化物的水化物为氢氧化铝,二者反应生成偏铝酸钾与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:KOH;Al(OH)3+OH-=AlO2-+2H2O
(3)非金属性O>S>P,元素非金属性越强,氢化物还原性越弱,故还原性为:PH3>H2S>H2O,
故答案为:PH3>H2S>H2O;
(4)⑤、⑧的氢化物分别为 NH3、HCl,相互反应产生白色固体为NH4Cl,对该固体中阳离子为NH4+,可与碱反应生成碱性气体NH3,再利用湿润的红色石蕊试纸碱性检验,具体实验方案为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),
故答案为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生);
(5)两种均含①④⑦和氢元素四种元素的化合物相互反应,是亚硫酸氢钠与硫酸氢钠反应生成硫酸钠、二氧化硫与水,反应方程式为:NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O,
故答案为:NaHSO3+NaHSO4=Na2SO4+SO2↑+H2O;
(6)反应中硝酸起氧化剂与酸的作用,NO3-减少2.2×10-3mol,说明起氧化剂作用的硝酸为2.2×10-3mol,76.8mgCu的物质的量=$\frac{76.8×1{0}^{-3}g}{64g/mol}$=0.0012mol,则硝酸铜物质的量0.0012mol,由硝酸根守恒离子,其酸性作用的硝酸为0.0012mol×2=0.0024mol,故参加反应硝酸为2.2×10-3mol+0.0024mol=4.4×10-3mol,故溶液中溶液中H+减少了4.4×10-3mol,
故答案为:减少;4.6×10-3mol.
点评 本题主要考查元素周期表与元素周期律,是对学生综合能力的考查,(6)中注意利用守恒法解答,难度中等.


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲苯分子中的所有原子可能共平面 | |
| B. | 苯乙烯分子中的所有原子可能共平面 | |
| C. | 二氯甲烷分子为正四面体结构 | |
| D. | 丁烷分子中的所有碳原子不可能都在同一平面内 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 离子还原性:A(n+1)+>Bn+,离子氧化性:C(n+1)->Dn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁件上镀铜时,金属铜作阴极 | |
| B. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为CH3OH+6OH-+6e-═CO2+5H2O | |
| C. | 纯锌与稀硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 | |
| D. | 电解精炼铜时,电解质溶液中铜离子浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏液体时,冷水应从冷凝管的上端进入,下端流出,符合水往低处流原理 | |
| B. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧靠烧杯内壁 | |
| C. | 进行蒸发操作时,待固体全部析出时再停止加热 | |
| D. | 分液时,当静置分层后,打开旋塞,使下层液体流出,待下层液刚好流尽后,立即关闭旋塞,再换另一只烧杯,再打开旋塞,将上层液体流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
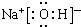 .AB-离子的电子式为
.AB-离子的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com