
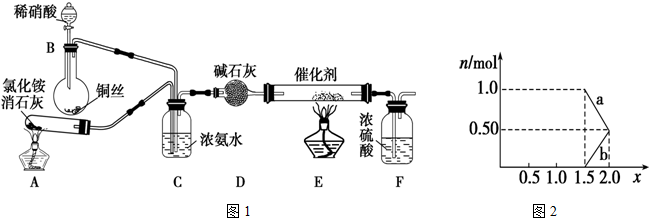
���� ��1�����Ȼ�粒�����������ƹ����ڼ��ȵ������·�����Ӧ���ɰ�����
�ڰ����Ǽ������壬�����ü�ʯ�������
��Ũ��ˮ���лӷ��ԣ����Բ��������������Ǽ�������ˮ�����壬���ᷴӦ��������������Ӧ��
��2���ٵ�NOx��Na2CO3��Һ��ȫ����ʱ����n��NO2����n��NO�����ݴ����ش�
�����ü������غ㷨��������⼴�ɣ�
�����ò���������NO��NO2�����ʵ������ٸ���ƽ��Ħ������������xֵ��
��3�����������ж����Ի�������Ⱦ��
��� �⣺��1�����Ȼ�粒�����������ƹ����ڼ��ȵ������·�����Ӧ���ɰ���������װ��A�ķ�Ӧ�ǣ�2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
�ʴ�Ϊ��2NH4Cl+Ca��OH��2$\frac{\underline{\;\;��\;\;}}{\;}$CaCl2+2NH3��+2H2O��
�ڰ����Ǽ������壬�����ü�ʯ�������װ��D�м�ʯ�ҵ������dz�ȥ�����е�ˮ������
�ʴ�Ϊ����ȥ�����е�ˮ������
��A������Ӧ���ɰ�����Cװ����Ũ��ˮ���лӷ��ԣ����Բ���������������������ˮ�����������������������ж����壬װ�ò��������ŷŵ���������Ⱦ������
�ʴ�Ϊ������������β�����е���������Ⱦ������
��2�����ɷ���ʽ��֪��NO�������ܱ����գ�NO��NO2������屻NaOH��Һ��ȫ���գ�����n��NO2����n��NO����1����n��NO2����n��NO��=1ʱxֵ��С��x��СֵΪ$\frac{2+1}{2}$=1.5����Ϊ����NO������x���ֵ��2����x��ȡֵ��ΧΪ1.5��x��2������x��ֵ��������1.2��
�ʴ�Ϊ��C��
���ü�������x=1.5����ӦΪNO��NO2�������ʵ�����Ϊ1��1������ʽ��Ӧ��û��NO3-����aӦ�ñ�ʾNO2-��������b��ʾNO3-��
���غ㷨����Ӧ���ɵ�NaNO3��NaNO2�е�Ԫ������Ԫ��֮��Ϊ1��1������1mol NOx����ȫ����������̼����0.5mol������Ϊ53g�������̼������Һ������=$\frac{53g}{26.5%}$=200g��
�ʴ�Ϊ��NO3-��200��
������NO2�ʹ��Ӧ����CO2Ϊamol��
��NO��NO2�봿�Ӧ������CO2Ϊbmol��
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ��������
1mol��m=48g
amol 48ag
NO+NO2+Na2CO3=2NaNO2+CO2 ��������
1mol��m=32g
bmol 32bg
a+b=1
48a+32b=40
���
a=0.5mol
b=0.5mol
n��NO2��=0.5mol��2+0.25mol=1.5mol
n��NO��=0.5mol
x=$\frac{0.5mol��1+1.5mol��2}{0.5mol+1.5mol}$=$\frac{7}{4}$��
�ʴ�Ϊ��$\frac{7}{4}$��
��3�����������ж����Ի�������Ⱦ���ô������յ��������ܽ��ж�����ת��Ϊ�����ʣ���ֹ�ж��������Ⱦ��
�ʴ�Ϊ�����ж�����ת��Ϊ�����ʣ���ֹ�ж��������Ⱦ��
���� �����Ե�������Ϊ���忼�������ʼ�ķ�Ӧ����ȷ���ʵ������ǽⱾ��ؼ����ѵ��ǣ�2����ļ��㣬Ҫ��Ϸ���ʽ�и���������֮��Ĺ�ϵʽ��𣬻���������Ϣ����xֵ���Ѷ��еȣ�


 �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| X | ��ֲ����������ȱ�ٵ�Ԫ�أ��ǵ����ʵ���Ҫ�ɷ� |
| Y | �ؿ��к����ӵ�һλ |
| Z | ����������ԭ�Ӱ뾶��� |
| Q | �����д���ʹ����Ͻ���Ʒ����ҵ�Ͽ��õ����������ķ����Ʊ��䵥�� |
| M | ��ˮ�д���������Ԫ��֮һ������������ϼ��븺�۵Ĵ�����Ϊ6 |
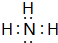 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϡ���ᷴӦ��Fe+2H+�TFe2++H2�� | |
| B�� | ̼�������Һ�����ᷴӦ��Ca��HCO3��2+2H+�TCa2++2H2O+2CO2�� | |
| C�� | ���������������Һ��Ӧ��CH3COOH+OH-�TCH3COO-+H2O | |
| D�� | ̼��þ�����ᷴӦ��MgCO3+2H+�TMg2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Ӧ�еĻ�ԭ����C����������S��KNO3 | |
| B�� | ����ըҩ��ԭ��֮һ�ǹ������ʷ�Ӧ�����˴��������� | |
| C�� | �ɴ˷�Ӧ���Ƴ�S��������ǿ��N2 | |
| D�� | �����ɱ�״����4.48L����ʱ����ת�Ƶ���0.6 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6 mol/L | B�� | 3 mol/L | C�� | 2.25mol/L | D�� | 1.13 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
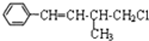
| A�� | 1mol���л����ڼ��Ⱥʹ��������£�����ܺ�4molH2��Ӧ | |
| B�� | ���л������ʽΪC11H13Cl | |
| C�� | ���л�������������Һ������ɫ���� | |
| D�� | ���л�����һ�������£��ܷ�����ȥ��Ӧ��ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ��Һ�У������Ҵ����ѵ����H+���� | |
| B�� | �����ڿ�����ȼ�����ɶ�����̼�����������ˮ | |
| C�� | ���������붡��Ϊͬϵ�� | |
| D�� | �е㲻ͬ�Ķ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����ʣ�� | |
| B�� | ����Һ�е�����ɫKSCN��Һ���Ժ�ɫ | |
| C�� | Fe2+��Fe3+���ʵ���֮��Ϊ6��1 | |
| D�� | ���������뻹ԭ��������ʵ���֮��Ϊ2��5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����������һ�ֳ�����ʳƷ��������ʵ�����Ʊ�������ķ�Ӧװ����ͼ���й����������
����������һ�ֳ�����ʳƷ��������ʵ�����Ʊ�������ķ�Ӧװ����ͼ���й����������| ��Է������� | �۵�/�� | �е�/�� | �ܽ��� | |
| �ױ� | 92 | -94.9 | 110.6 | ������ˮ |
| ������ | 122 | 122.13 | 249 | ����ˮ |
| �������� | 144 | - | 249.3 | ������ˮ |
 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com