
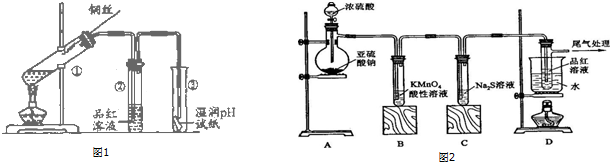
 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.请回答下列问题.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.请回答下列问题.分析 (1)铜与浓硫酸加热反应生成二氧化硫气体,烧瓶中压强增大,导致气体不能顺利留下;
(2)铜和热的浓硫酸反应生成二氧化硫、硫酸铜和水;
(3)二氧化硫与品红作用,二氧化硫具有漂白性;二氧化硫与氯水作用,二氧化硫具有还原性;
(4)铜和热的浓硫酸反应,生成的二氧化硫为大气污染物,氢氧化钠和二氧化硫反应生成亚硫酸钠和水.
解答 解:(1)由于铜与浓硫酸加热生成二氧化硫气体,随着反应的进行,圆底烧瓶内压强增大,导致液体不能顺利滴下,所以反应停止了,
故答案为:随着反应的进行,圆底烧瓶内压强增大,导致液体不能顺利滴下;
(2)铜和热的浓硫酸反应铜作还原剂,硫酸作氧化剂,生成二氧化硫、硫酸铜和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)二氧化硫与品红溶液反应生成不稳定的无色物质,二氧化硫与品红作用,二氧化硫具有漂白性;二氧化硫具有还原性,能被氯水氧化,氯水褪色,发生O2+C12+2H2O=H2SO4+2HC1,
故答案为:C;B;
(4)SO2是酸性氧化物,也是大气污染物,所以用NaOH溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,反应的方程式为:2NaOH+SO2=Na2SO3+H2O,
故答案为:吸收尾气,防止污染.
点评 本题考查了浓硫酸的性质,题目难度不大,明确发生反应的实质为解答关键,注意掌握二氧化硫的性质及检验方法,试题侧重考查学生的分析、理解能力你化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 32克O2所含的原子数目为2NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液 | |
| C. | 滴定时,应左手控制活塞,右手摇动锥形瓶,眼睛时刻注视着锥形瓶内颜色的变化 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
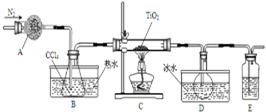 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产白雾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com