
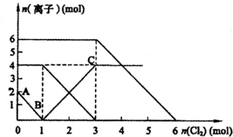
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.

科目:高中化学 来源: 题型:
| A、铁与稀硫酸反应 Fe+2H+=Fe3++H2↑ | ||
| B、Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | ||
| C、氯气与水反应:Cl2+H2O=Cl-+2H++ClO- | ||
D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有0.5mol H |
| B、含有1mol H+ |
| C、含有H2分子数为 6.02×1023 |
| D、含有H原子数为 6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠具有强还原性 |
| B、二氧化碳在一定条件下具有氧化性 |
| C、氧气通常具有氧化性而不具有还原性 |
| D、盐酸只具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性溶液中:Al3+、Fe3+、SO42-、SCN- |
| B、透明溶液中:MnO4-、K+、Na+、NO3- |
| C、加入铝粉后产生氢气的溶液中:Ba2+、K+、NO3-、Al3+ |
| D、强酸性溶液中:Na+、Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Al |
| B、Al和Fe |
| C、Fe和Zn |
| D、Mg和Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有0.5 mol H2 |
| B、含有3.01×1023个水分子 |
| C、质量为9 g/mol |
| D、在标准状况下的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类 | 名称(或俗名) | 化学式 | |
| A | 碱性氧化物 | 氧化碳 | FeO |
| B | 酸性氧化物 | 一氧化碳 | CO |
| C | 酸 | 亚硫酸 | H2S |
| D | 盐 | 纯碱 | Na2CO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com