
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成n mol NO的同时,消耗n mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v逆(H2O)
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、D和E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中相对位置如图①所示,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为N2H4,可做火箭燃料;甲、乙为非金属单质;X分子中含有10个电子。它们之间的转化关系如图②所示。
图①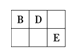 图②
图②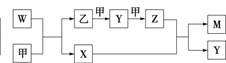
回答下列问题:
(1)甲和乙生成标准状况下1.12 L Y,吸收9.025 kJ热量,写出反应的热化学方程式:________。
(2)一定量E的单质与NaOH溶液恰好完全反应后,所得溶液的pH__7(填“大于”“等于”或“小于”),原因是____(用离子方程式表示)。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时,正极反应式为_____,负极反应式为______。
(4)将一定量的A2、B2混合气体放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡。测得平衡气体的总物质的量为0.50 mol,其中A2为0.3 mol,B2为0.1 mol。则该条件下A2的平衡转化率为____,该温度下的平衡常数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的基础化工原料,在一定条件下可发生下列转化:
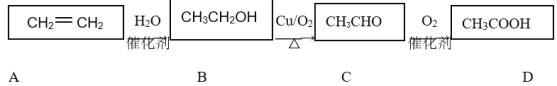
请根据题意填空:
(1)CH3COOH的官能团为________(填“羟基”或“羧基”);
(2)既能使溴水褪色,又能使酸性高锰酸钾溶液褪色的是________(填“A”或“B”);
(3)完成B→C的化学方程式:2CH3CH2OH+O2![]() 2CH3CHO+__________。
2CH3CHO+__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
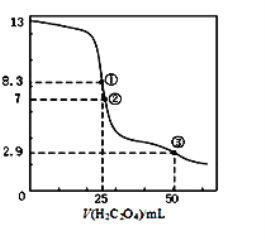
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如下图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
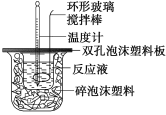
(1)烧杯间填满碎泡沫塑料的作用是_________;
(2)环形玻璃搅拌棒能否用环形铁质搅拌棒代替?_____(填“能”或“不能”),其原因是_________
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_________;实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量_____(填“相等”或“不相等”),若实验操作均正确,则所求中和热________(填“相等”或“不相等”);
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol 水时,放出57.3 kJ的热量,则上述反应的热化学方程式为: _____________。
(5)倒入NaOH溶液的正确操作是 _________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)某同学利用实验数据计算出的中和热与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差;
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度;
c.量取NaOH溶液的体积时仰视读数;
d.倒完NaOH溶液后,发现装NaOH烧杯内有极少量残留液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3固体和NaHCO3固体性质的有关叙述中正确的是( )
A.在水中溶解性:Na2CO3>NaHCO3
B.热稳定性:Na2CO3<NaHCO3
C.与相同浓度的盐酸反应的速度:Na2CO3>NaHCO3
D.配成溶液后分别测定pH,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示实验合理的是
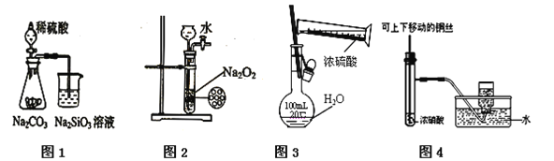
A. 图1为证明非金属性强弱:S > C > Si
B. 图2为制备少量氧气
C. 图3为配制一定物质的量浓度的硫酸溶液
D. 图4为制备并收集少量NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用CO具有重要意义。
(1)CO可设计成燃料电池,熔融Li2CO3和Na2CO3的混合物作为燃料电池的电解质,氧化剂是含CO2的O2,工作时正极反应为__________________,以该燃料电池为电源处理含氮氧化物废气,可回收硝酸,同时制得副产物氢气,装置如图所示(电极均为石墨电极)。该装置中应选用_______(填“阴”或“阳”)离子交换膜,写出电解时NO2发生反应的电极反应式:___________________。

(2)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
反应 | △H(kJ/mol) |
I. Fe2O3(s)+3C(s) | +489 |
II. Fe2O3(s)+3CO(g) | -27 |
III. C(s)+CO2(g) | X |
试计算,试计算,X=_________。
T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应I,反应达到平衡后,在t1时刻改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是_____________________。
a.保持温度、体积不变,使用催化剂 b.保持体积不变,升高温度
c.保持温度不变,压缩容器体积 d.保持温度、体积不变,充入CO

(3)在一定温度下,向某体积可变的恒压(P总)密闭容器中加入1mol CO2与足量的碳发生反应III,平衡时体系中气体体积分数与温度的关系如图所示。
①650℃时,反应达平衡后CO2的转化率为____________。
②T℃时,该反应达到平衡时下列说法不正确的是__________________。
a.气体密度保持不变
b.2v正(CO2)=v正(CO)
c.若保持其它条件不变再充入等体积的CO2和CO,平衡向逆反应方向移动
d.若保持其它条件不变再充入惰性气体,v正、v逆均减小,平衡不移动
e.若其它条件不变将容器体积压缩至一半并维持体积不变,再次达平衡时压强小于原平衡的2倍
③根据图中数据,计算反应III在T℃时用平衡分压代替平衡浓度表示的化学平衡常数KP=___________(设总压强为P总,用含P总的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com