
某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g),ΔH<0的正、逆反应速率的影响如图所示:
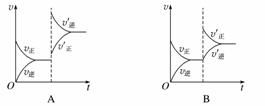
(1)加催化剂对反应速率影响的图像是________(填序号,下同),平衡________移动。
(2)升高温度对反应速率影响的图像是__________,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是________,平衡向________方向移动。
(4)增大O2的浓度对反应速率影响的图像是__________,平衡向________方向移动。
答案 (1)C 不 (2)A 逆反应 (3)D 逆反应
(4)B 正反应
解析 (1)加入催化剂,正、逆反应速率均增大,图像上应该出现“断点”,且应在原平衡的反应速率之上;催化剂使正、逆反应速率增大的倍数相同,则改变条件后的速率线应该平行于横坐标轴,图像为C。
(2)升高温度,正、逆反应速率均增大,图像上应该出现“断点”且应在原平衡的反应速率之上。因题给反应的正反应放热,升温平衡逆向移动,所以v正′<v逆′,图像为A。
(3)增大反应容器体积即减小压强,正、逆反应速率均减小,图像上应该出现“断点”且应在原平衡的反应速率之下。因减小压强平衡逆向移动,所以v正′<v逆′,图像为D。
(4)增大O2的浓度,正反应速率会“突然增大”,图像上出现“断点”且应在原平衡的反应速率之上,但逆反应速率应该在原来的基础上逐渐增大,图像为B。


科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操 作 | 现 象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是___________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是________。
(3)向水中持续通入SO2,未观察到白雾。推测现象ⅰ的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是________。
②由实验a、b不能判断白雾中含有HCl,理由是____________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X。
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
据新浪科技网报道:美国科学家发现,普通盐水在无线电波的照射下可以燃烧,这很可能是21世纪人类最伟大的发现之一,将有望解决未来人类的能源危机。无线电频率可以降低盐水中所含元素之间的结合力,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是( )
A.离子键 B.共价键
C.一种静电引力 D.一种静电斥力
查看答案和解析>>
科目:高中化学 来源: 题型:
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。分别以铅片、铝片为电极,以硫酸溶液为电解液,按照如图所示装置连接电解池装置,电解40 min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30 min,即可得到更加致密的氧化膜。下列有关说法正确的是 ( )。

A.电解时电子从电源负极→导线→铝极,铅极→导线→电源正级
B.在电解过程中,H+向阳极移动,SO 向阴极移动
向阴极移动
C.电解过程阳极周围溶液的pH下降
D.电解的总反应为2Al+6H+===2Al3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为相互串联的甲、乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发现石墨电极附近先变红。请回答:
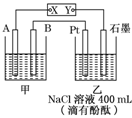
(1)电源X极为______极(填“正”或“负”),乙池中Pt电极上的电极反应式为______。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为______,电路中通过的电子为______mol。
(3)若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在等温等压条件下,可逆反应2A(g)+B(g)3C(g)+D(g)起始物质的量如下表所示:
| 序号 | A | B | C | D |
| ① | 2 mol | 1 mol | 0 | 0 |
| ② | 4 mol | 2 mol | 0 | 0 |
| ③ | 1 mol | 0.5 mol | 1.5 mol | 0.5 mol |
| ④ | 0 | 1 mol | 3 mol | 1 mol |
| ⑤ | 0 | 0 | 3 mol | 1 mol |
上述反应达到平衡后,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2CH3OH(g)CH3OCH3(g)+H2O(g)。某温度下的平衡常数为400。在此温度下,向密闭容器中加入一定量CH3OH,反应到5 min时测得各组分的浓度如表所示:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
(1)该反应在低温下(此时水为液态)能自发进行,则该反应的ΔH______0(填“>”、“<”或“=”,下同)。
(2)比较此时正、逆反应速率的大小:v正______v逆。
(3)前5 min时,用CH3OCH3表示该反应的速率为________________。
(4)再过一段时间后,反应达到平衡状态。能判断该反应已达到化学平衡状态的依据是__________(填字母)。
A.容器中压强不变
B.混合气体中c(CH3OH)不变
C.v生成(CH3OH)=2v消耗(H2O)
D.c(CH3OCH3)=c(H2O)
(5)达到平衡状态时,CH3OH的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是 ( )。
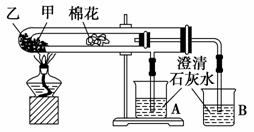
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热不久就能看到A烧杯的澄清石灰水变浑浊
D.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com