
| ||
| ||
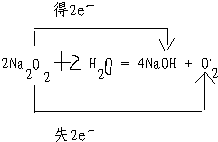


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:| 装置 | A (试管+粉末) |
B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源:肇庆一模 题型:多选题
| A.温度升高,H2O(g)的转化率增大 | ||
B.反应的化学平衡常数的表达式为k=
| ||
| C.增大压强后,V正、V逆如图所示 | ||
| D.利用该反应原理可以在铁表面附上一层保护层,减少铁的腐蚀 |

查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源:2010年上海市虹口区高三第二次模拟考试化学试题 题型:单选题
把铝粉与Fe3O4的混合物,分为两等份。前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH溶液充分反应。前后两种情况下生成的气体在同温同压下的体积比是
| A.1:1 | B.3:4 | C.9:8 | D.4:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com