
| ���� | Fe��OH��2 | Cu��OH��2 | Fe��OH��3 |
| Ksp/25�� | 8.0��10-16 | 2.2��10-20 | 4.0��10-38 |
| ��ȫ����ʱ��pH��Χ | ��9.6 | ��6.4 | 3��4 |
| A�� | ��û����Һ����μ���NaOH��Һ�����ȿ������ɫ���� | |
| B�� | ����Һ��c��SO42-����[c��Cu2+��+c��Fe2+��+c��Fe3+��]��5��4 | |
| C�� | �����Һ�м���������ˮ��������pH��3��4����ˣ��ɻ�ô�����CuSO4��Һ | |
| D�� | ��pH=5����Һ��Fe3+���ܴ������� |
���� A������ͼ�����������������ȿ�ʼ������
B��Cu2+��Fe2+��Fe3+����ˮ�⣬������ǵ����ʵ�������٣�
C�������Һ�м�����ˮ������������Ϊ�����ӣ�������ҺPH=3��4�����ӳ�����ȫ�����˵õ���Һ������ͭ��Һ��HCl��Һ��H2SO4��Һ��
D����ͼ����֪Fe3+��PH=3��4�Ѿ���ȫ������
��� �⣺A�����������ӳ�����PH��֪��������������Һ�ȳ��������������������ȿ������Ǻ��ɫ��������A��ȷ��
B�������ʵ�����CuSO4��FeSO4��Fe2��SO4��3����Һ�������ʵ���Ϊ1mol��n��SO42-��=5mol��n��Cu2+��+n��Fe2+��+n��Fe3+��=4mol����Cu2+��Fe2+��Fe3+��ˮ��Һ�з���ˮ�⣬���Ըû����Һ��c��SO42-����{c��Cu2+��+c��Fe2+��+c��Fe3+��}��5��4����B��ȷ��
C����û����Һ�м���������ˮ����ˮ������������Ϊ�����ӣ�������Ӧ6FeSO4+3Cl2=2Fe2��SO4��3+2FeCl3����������Һ��pHΪ3��4��Ȼ����ˣ��õ���Һ������ͭ��Һ��HCl��Һ��H2SO4��Һ�����ܵõ�������CuSO4��Һ����C����
D����ͼ����֪Fe3+��PH=3��4�Ѿ���ȫ����������PH=5����Һ��Fe3+���ܴ������ڣ���D��ȷ��
��ѡC��
���� ���⿼�������ӳ��������ķ����жϣ�����ˮ���Ӧ�ã�����ʵ�鷽����Ӧ�ã���Ŀ�Ѷ��еȣ�


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
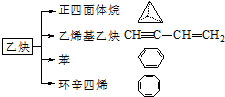 ��Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������»����
��Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������»����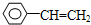 ��
��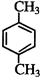 ��
��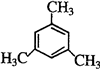 ��
�� ����д���йػ�ѧ��Ӧ����ʽ��CH��CH+HCl$��_{��}^{����}$CH2=CHCl��nCH2=CHCl$\stackrel{һ������}{��}$
����д���йػ�ѧ��Ӧ����ʽ��CH��CH+HCl$��_{��}^{����}$CH2=CHCl��nCH2=CHCl$\stackrel{һ������}{��}$ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��n��ˮ����ˮ���е������� | |
| B�� | ��n�����ֱ�����������������ȫ��Ӧʱת�Ƶĵ����� | |
| C�� | ��m����ϩ�ͱ�ϩ�к��еĹ��õ��Ӷ��� | |
| D�� | ͬ�¡�ͬѹͬ�����CO��NO���е������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
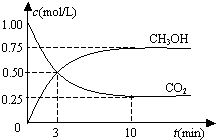 ���º����ܱ������г���1mol CO2��3mol H2��һ�������·�����Ӧ��
���º����ܱ������г���1mol CO2��3mol H2��һ�������·�����Ӧ��| A�� | ���ܱ����������Ϊ1 L | |
| B�� | ��Ӧ��ƽ�⣬������ת����Ϊ0.75 | |
| C�� | ��Ӧ��ƽ�⣬����ƽ����Ӧ����0.075 mol/��L•min�� | |
| D�� | CO2��H2O���ʵ������ٸı�ʱ��Ӧ��ƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
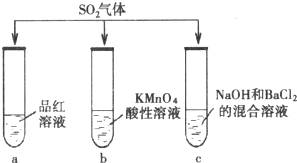 ̽��SO2�����ʣ�����ͬѧ��SO2�ֱ�ͨ������3����Һ�У�
̽��SO2�����ʣ�����ͬѧ��SO2�ֱ�ͨ������3����Һ�У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Է����еĻ�ѧ��Ӧ��һ���Ƿ��ȷ�Ӧ | |
| B�� | �Է����̽�������ϵ�������� | |
| C�� | ��H-T��S��0�ķ�Ӧ������Ҫ�κ������Ϳ��Է����� | |
| D�� | ͬһ���ʵ�����Һ��������״̬����ֵ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2SO4•10H2O��ˮ�����ȹ��� | |
| B�� | �ϳ�ʱ������������Na2SO4•10H2O��ˮ�ǽ����Ĺ��� | |
| C�� | ����ڸ������£������ĸ��ֽⷴӦ�����ȷ�Ӧ | |
| D�� | NH4NO3����ˮ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��C6Hl0O5��n+nH2O$\frac{\underline{\;����\;}}{\;}$nC6H12O6 ���ۣ�����ά�أ� ������ | |
| B�� | CH3COOH+CH3CH2OH$\frac{\underline{\;Ũ����\;}}{��}$CH3COOC2H5+H2O | |
| C�� | CH2=CH2+Br2$\stackrel{CCl_{2}}{��}$CH2BrCH2Br | |
| D�� | 2CH3CH2OH+O2$��_{��}^{Cu}$2CH3CHO+2H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com