
| A. | 0.1 mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1 L0.05mol?L-1 CH3 COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准状况下,44.8 LCCl4含有的分子数为2NA | |
| D. | 反应:ClO3-+5Cl-+6H+=3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |
分析 A、氢氧化钠由1个钠离子和1个氢氧根构成;
B、醋酸是弱酸,在溶液中不能完全电离;
C、标况下四氯化碳为液态;
D、反应:ClO3-+5Cl-+6H+=3Cl2+3H2O转移5mol电子,生成3mol氯气.
解答 解:A、氢氧化钠由1个钠离子和1个氢氧根构成,故0.1mol氢氧化钠中含0.1NA个阴离子,故A正确;
B、醋酸是弱酸,在溶液中不能完全电离,故溶液中的氢离子的个数小于0.05NA个,故B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、反应:ClO3-+5Cl-+6H+=3Cl2+3H2O转移5mol电子,生成3mol氯气,故当生成1mol氯气时转移$\frac{5}{3}$NA个电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
| 编号 | 酸的种类 | 酸的浓度/mol•L-1 | 酸的体积/mL | 镁条质量/g |
| 1 | 醋酸 | 1.0 | 10 | 2.0 |
| 2 | 盐酸 | c | 10 | 2.0 |
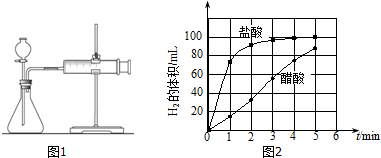
| 编号 | 反应温度/℃ | Na2S2O3溶液/mL | 甲 | 0.10mol/L H2SO4溶液/mL | 乙 |
| 1 | 25℃ | 10.0 | 0 | 10.0 | |
| 2 | 25℃ | 5.0 | a | 10.0 | |
| 3 | 45℃ | 10.0 | 0 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中NH4+、Al3+、NO3-、Cl-可以共存 | |
| B. | 氧化镁可以用作耐火材料 | |
| C. | 淀粉和纤维素都可用(C6H10O5)n表示,二者互为同分异构体 | |
| D. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,50 g 98%浓硫酸和50 g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4 L 气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1 mol N2与足量H2反应生成NH3,有6NA个共价键生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化 | |
| D. | 金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g 30% CH3COOH溶液中含氢原子数为2NA | |
| B. | 标准状况下,11.2 L CCl4中含有C-Cl键的数目为2NA | |
| C. | 16gO3和O2混合物中含氢原子数为NA | |
| D. | 精炼铜过程中阳极质量减少6.4g时,电路中转移电子数等于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
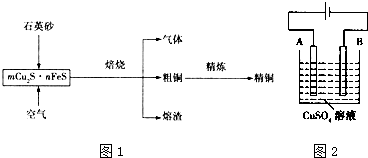
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com