
| A£® | ½šøÕŹÆ±ČŹÆÄ«ĪČ¶Ø | |
| B£® | 1molŹÆÄ«±Č1mol½šøÕŹÆµÄ×ÜÄÜĮæøß | |
| C£® | ČōŌŚµČĮæŃõĘųÖŠ³ä·ÖČ¼ÉÕ£¬1mol½šøÕŹÆ±Č1molŹÆÄ«µÄŹĶ·ÅµÄÄÜĮæøß | |
| D£® | ½öĢį¹©1.895 kJµÄČČÄÜ£¬¹¤ŅµÉĻ¾ĶÄܽ«1molŹÆÄ«×Ŗ»ÆĪŖ½šøÕŹÆ |
·ÖĪö ÓÉŠÅĻ¢”°100kPaŹ±£¬1molŹÆÄ«×Ŗ»ÆĪŖ½šøÕŹÆ£¬ŅŖĪüŹÕ1.895kJµÄČČÄÜ”±æÉÖŖ£¬ŹÆÄ«×Ŗ»ÆĪŖ½šøÕŹÆĪŖĪüČČ·“Ó¦£¬ŹÆÄ«ÄÜĮæµĶ£¬ŹÆÄ«ĪČ¶Ø£¬ŅŌ“ĖĄ“½ā“š£®
½ā“š ½ā£ŗA£®ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬ŹÆÄ«±Č½šøÕŹÆĪČ¶Ø£¬¹ŹA“ķĪó£»
B.1molŹÆÄ«±Č1mol½šøÕŹÆµÄ×ÜÄÜĮæµĶ£¬¹ŹB“ķĪó£»
C£®Č¼ÉÕ¾łĪŖ·ÅČČ·“Ó¦£¬Éś³ÉĪļĻąĶ¬£¬½šøÕŹÆÄÜĮæøߣ¬ŌņČōŌŚµČĮæŃõĘųÖŠ³ä·ÖČ¼ÉÕ£¬1mol½šøÕŹÆ±Č1molŹÆÄ«µÄŹĶ·ÅµÄÄÜĮæøߣ¬¹ŹCÕżČ·£»
D£®Ņņ¹¤Ņµ×Ŗ»ÆŹ±ÄÜĮæÓŠĖšŹ§£¬Ōņ½öĢį¹©1.895 kJµÄČČÄÜ£¬¹¤ŅµÉĻ²»Äܽ«1molŹÆÄ«×Ŗ»ÆĪŖ½šøÕŹÆ£¬¹ŹD“ķĪó£»
¹ŹŃ”C£®
µćĘĄ ±¾Ģā漲鷓ӦČČÓėģŹ±ä£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕ·“Ó¦ÖŠÄÜĮæ±ä»Æ”¢ĪČ¶ØŠŌÓėÄÜĮæµÄ¹ŲĻµĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄæ¼²é£¬Ń”ĻīDĪŖŅדķµć£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č/”ę | 200 | 300 | 400 |
| K | 290 | 39 | 11.7 |
| ŹµŃé¢ń | ŹµŃé¢ņ | |
| ĶØČėĘųĢå | CO”¢H2 | CO”¢H2”¢H2O£Øg£© |
| ¹ĢĢå²śĪļ | Fe3O4”¢Fe | Fe3O4 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·“Ó¦ÖŠCu2OÖ»×÷Ńõ»Æ¼Į | |
| B£® | ČōÓŠ28.8g Cu2O²Ī¼Ó·“Ó¦£¬Ōņ×ŖŅʵē×ÓŹżĪŖ0.2NA | |
| C£® | Cu2OµÄĪČ¶ØŠŌ±ČCuOČõ | |
| D£® | Čē¹ūČÜŅŗÖŠ³öĻÖĄ¶É«£¬ĖµĆ÷CuOŅŃ·Ö½ā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | MgŌ×ӵĽį¹¹Ź¾ŅāĶ¼£ŗ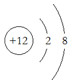 | B£® | OCl2·Ö×ӵĵē×ÓŹ½£ŗ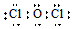 | ||
| C£® | HF·Ö×ӵĵē×ÓŹ½£ŗ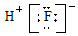 | D£® | Na2SŠĪ³ÉµÄµē×ÓŹ½ 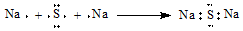 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
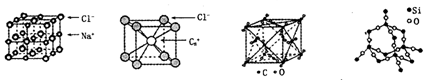
| A£® | Ķ¬Ņ»Ö÷×åµÄŌŖĖŲÓėĮķŅ»ĻąĶ¬ŌŖĖŲĖłŠĪ³ÉµÄ»ÆѧŹ½ĻąĖʵÄĪļÖŹ²»Ņ»¶Ø¾ßÓŠĻąĶ¬ µÄ¾§Ģå½į¹¹ | |
| B£® | ĀČ»ÆÄĘ”¢ĀČ»Æļ¤ŗĶ¶žŃõ»ÆĢ¼µÄ¾§Ģ嶼ӊĮ¢·½µÄ¾§°ū½į¹¹£¬ĖüĆĒ¾ßÓŠĻąĖĘĪļĄķ ŠŌÖŹ | |
| C£® | ¶žŃõ»ÆĢ¼¾§ĢåŹĒ·Ö×Ó¾§Ģ壬ĘäÖŠ²»½ö“ęŌŚ·Ö×Ó¼ä×÷ÓĆĮ¦£¬¶ųĒŅŅ²“ęŌŚ¹²¼Ū¼ü | |
| D£® | ¶žŃõ»Æ¹č¾§Ģå²»ŹĒĆܶѻż½į¹¹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °×Į×ŗĶŗģĮ× | B£® | ¼×ĶéŗĶ±ūĶé | ||
| C£® | 1HŗĶ2H | D£® | CH3CH2OHŗĶCH3OCH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼Ō×ÓÖ®¼ä£¬Ģ¼Ō×ÓÓėĘäĖūŌ×Ó£ØČēĒāŌ×Ó£©Ö®¼ä¶¼æÉŅŌŠĪ³É4øö¹²¼Ū¼ü | |
| B£® | Ģ¼Ō×ÓŠŌÖŹ»īĘĆ£¬æÉŅŌÓė¶ąŹż·Ē½šŹōŌŖĖŲŌ×ÓŠĪ³É¹²¼Ū¼ü | |
| C£® | Ģ¼Ō×ÓÖ®¼ä¼ČæÉŅŌŠĪ³ÉĪČ¶ØµÄµ„¼ü£¬ÓÖæÉŅŌŠĪ³ÉĖ«¼üŗĶČż¼ü | |
| D£® | ¶ąøöĢ¼Ō×ÓæÉŅŌŠĪ³É³¤¶Č²»Ķ¬µÄĮ“¼°»·£¬ĒŅĮ“”¢»·Ö®¼äÓÖæÉŅŌĻą»„½įŗĻ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Mg2+”¢Zn2+”¢Cr3+”¢Fe3+ | B£® | Cr3+”¢Fe3+”¢Zn2+”¢Mg2+ | ||
| C£® | Fe3+”¢Cr3+”¢Zn2+”¢Mg2+ | D£® | Zn2+”¢Mg2+”¢Cr3+”¢Fe3+ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com