
【题目】下列关于电解质溶液的叙述中正确的是 ( )
A. pH=0的H2SO4溶液与1 mol·L-1 的Ba(OH)2溶液中水的电离程度相同
B. 0.2mol·L-1 CH3COOH溶液中的c(H+)是0.1mol·L-1 CH3COOH中的c(H+)的2倍
C. 室温时,pH=2的CH3COOH和0.01mol·L-1 NaOH溶液等体积混合,混合后pH=7
D. 等物质的量浓度的Na2S和NaHS的混合溶液中:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)]
【答案】D
【解析】
A、pH=0的H2SO4溶液中c(H+)=1mol/L,则由水电离出的c(H+)=1×10-14mol/L;1 mol·L-1 的Ba(OH)2溶液中c(OH-)=2mol/L,则由水电离出的c(H+)=![]() ×10-14mol/L;二者中水的电离程度不同,故A错误;
×10-14mol/L;二者中水的电离程度不同,故A错误;
B、醋酸是弱电解质,浓度增大,醋酸的电离程度减小,所以0.2mol·L-1 CH3COOH溶液中的c(H+)小于0.1mol·L-1 CH3COOH溶液中的c(H+)浓度的2倍,故B错误;
C、pH=2的CH3COOH溶液中,氢离子浓度为0.01mol·L-1,醋酸的浓度大于0.01mol·L-1,故和0.01mol·L-1的氢氧化钠溶液等体积混合后,醋酸过量,溶液显酸性,即pH<7,故C错误;
D、等物质的量浓度的Na2S和NaHS溶液等体积混合,根据物料守恒可得:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)],所以D选项是正确的。
答案选D。


科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=______________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。
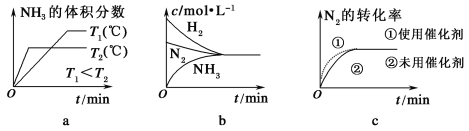
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
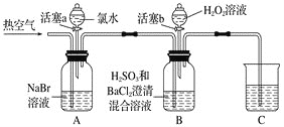
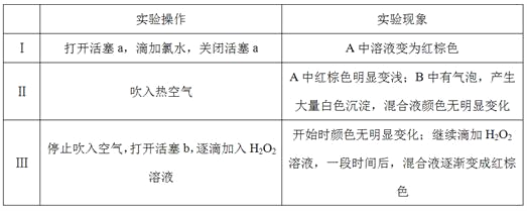
实验记录如下:
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工材料,二氧化硫与氧气反应生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
2SO3(g)在一定条件下经20分钟达到平衡,测得c(SO3)=0.040mol/L。
①从反应开始到达到平衡,用SO2表示的平均反应速率为________________
②从平衡角度分析采用过量O2的目的是____________;
③该反应的平衡常数表达式为K=___________。
④已知:K(300℃)>K(350℃),该反应是________(选填“吸”或“放”)热反应。若反应温度升高,SO2的转化率将_______(填“增大”、“减小”或“不变”)。

(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解,在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:
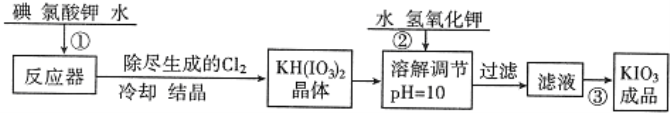
(1)已知步骤①反应器中发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,反应器中发生的化学方程式为6I2+11KClO3+3H2O→6KH(IO3)2+5KCl+3Cl2↑。参照碘酸钾的溶解度:
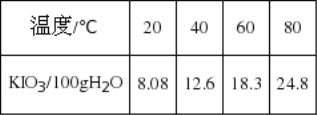
操作③得到碘酸钾晶体,方法是____________、____________:
(2)已知: KIO3+ 5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32—=2I—+S4O62—
检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有____________
(3)检验加碘食盐中碘的含量,学生乙设计的实验步骤如下:
①准确称取wg食盐,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得食盐溶液,加入过量KI溶液充分混合;
③以淀粉为指示剂,逐滴加入2.0╳10—3mol/L的Na2S2O310.0mL,恰好反应完全。
则加碘食盐样品中的碘元素含量是_____ mg/kg (以含w 的代数式表示)。
(4)学生丙又对纯净的NaCl进行了下列实验:

请推测实验中产生蓝色现象的可能原因____________,用化学方程式表示。
(5)根据学生丙的实验结果,学生乙测得的食盐中碘元素的含量可能____________ (填“偏高”、“偏低"或“准确")。原因是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,在20 mL 0.1 mol·L-1氨水溶液中逐滴加入0.1 mol·L-1HCl溶液,其pH与所加盐酸溶液体积(V/mL)的关系如图所示,下列说法正确的是 ( )
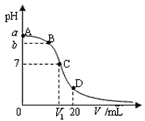
A. 当V=10mL时,溶液中存在: c(H+)+c(NH4+)=c(NH3·H2O)+c(OH-)
B. A、C间任一点,溶液可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. 在C点,V1<10mL,且有 c(NH4+)=c(Cl-)=c(OH-)=c(H+)
D. 在D点,存在:c(NH4+)+c(NH3·H2O)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___族。写出其基态原子的电子排布式_____。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___.(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____。
(3)Cu可以和EDA( )形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
)形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____,O2中σ和![]() 健的个数比是______。
健的个数比是______。
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(![]() ,
,![]() ,
,![]() ),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. N2(g)转化为氮原子是一个放热过程
B. 1mol N2和lmol O2的总能量比2molNO的总能量高
C. 1个NO(g)分子中的化学键断裂时需要吸收632kJ能量
D. 2NO(g)=N2(g)+O2(g)的反应热△H=-180 kJ/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(只含两种短周期元素)是一种重要的还原剂。某同学取X做了如下实验
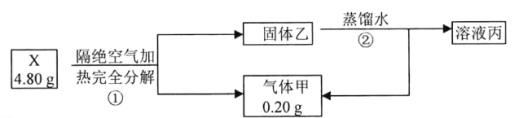
请回答:
(1)X的电子式是____________。
(2)写出X与水反应的化学方程式____________。
(3)X在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com