
 +2
+2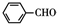 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$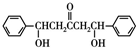 .
.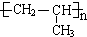 .
.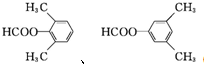 .
. (无机物任选).
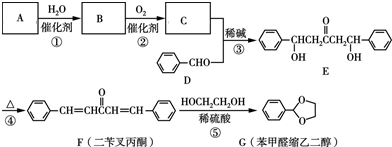
(无机物任选). 分析 烃A的相对分子质量为42,则$\frac{42}{14}$=3,故A的分子式为C3H6,且无环状结构,故A为CH3CH=CH2,A与水发生加成反应生成B,B氧化生成C,C与苯甲醛反应生成E,结合E与苯甲醛结构简式可知C为 ,则B为
,则B为 .E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮.
.E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮.
(5)乙醛与甲醛反应生成 ,再与氢气发生加成反应生成
,再与氢气发生加成反应生成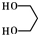 ,最后与二苄叉丙酮合成
,最后与二苄叉丙酮合成 .
.
解答 解:烃A的相对分子质量为42,则$\frac{42}{14}$=3,故A的分子式为C3H6,且无环状结构,故A为CH3CH=CH2,A与水发生加成反应生成B,B氧化生成C,C与苯甲醛反应生成E,结合E与苯甲醛结构简式可知C为 ,则B为
,则B为 .E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮.
.E加热发生消去反应生成F,F中碳碳双键断裂,乙二醇中O-H键断裂,发生取代反应生成G,同时还生成丙酮.
(1)B为 ,名称为2-丙醇,E中含氧官能团是羰基、羟基,
,名称为2-丙醇,E中含氧官能团是羰基、羟基,
故答案为:2-丙醇;羰基、羟基;
(2)④的反应类型是消去反应,③的反应方程式: +2
+2 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$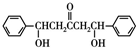 ,
,
故答案为:消去反应; +2
+2 $\stackrel{碱}{→}$
$\stackrel{碱}{→}$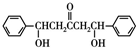 ;
;
(3)A为CH3CH=CH2,A加聚产物的结构简式是: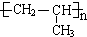 ,
,
故答案为: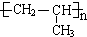 ;
;
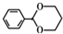
(4)G的芳香同分异构体中能发生银镜反应和水解反应,含有甲酸形成酯基,含有1个取代基,为-CH2CH2OOCH或者-CH(CH3)OOCH,含有2个取代基,为-CH3、-CH2OOCH,或者-CH2CH3、-OOCH,各有邻、间、对3种,含有3个取代基为2个-CH3、-OOCH,2个-CH3有邻、间、对3种,对应-OOCH位置分别有2种、3种、1种,符合条件的同分异构体共有14种,其中核磁共振氢谱只有四组峰的同分异构体结构简式为: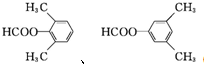 ,
,
故答案为:14;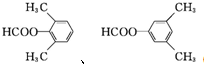 ;
;
(5)乙醛与甲醛反应生成 ,再与氢气发生加成反应生成
,再与氢气发生加成反应生成 ,最后与二苄叉丙酮合成
,最后与二苄叉丙酮合成 ,合成路线流程图为:
,合成路线流程图为: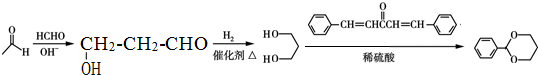 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,充分利用转化中物质的结构进行分析,查找考查学生分析推理能力、信息获取与迁移运用能力,难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 可能呈酸性 | B. | 不可能呈碱性 | ||
| C. | 可能呈中性或碱性 | D. | 不可能呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 向3支试管中各加入2mL 0.1mol•L-1酸性高锰酸钾溶液和2mL 0.01mol•L-1 H2C2O4溶液,将它们分别置于冰水、室温下、80℃热水中,观察比较褪色快慢 | |
| C. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬脂酸钠 | |
| D. | 为保证实验安全,金属钠切割下来的表层物质应放回原试剂瓶,不能在研钵中研磨氯酸钾或硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
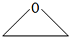 .
.
 ;
;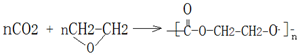 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 | |
| B. | 氢化锂也是一种储氢材料,供氢原理为LiH+H2O═LiOH+H2↑ | |
| C. | 生成等质量的氢气,反应①、②转移电子数之比为4:3 | |
| D. | LiAlH4是共价化合物,LiH是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞呈红色的溶液:Na+、NO3-、Ba2+、Br- | |
| B. | 加水稀释pH减小的溶液:K+、Al3+、Cl-、CH3COO- | |
| C. | 含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I- | |
| D. | c(OH-)<$\sqrt{{K}_{w}}$的溶液:ClO-、NO3-、Na+、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) | |
| B. | 向0.1 mol•L-1的NH4Cl溶液中通入一定量的NH3后:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 向CH3COOH溶液中滴加NaOH使pH>7溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 0.3 mol•L-1的 HY溶液与0.3 mol•L-1的NaOH溶液等体积混合后所得pH=9的溶液中:c(OH-)-c(HY)=c(H+)=1×10-9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
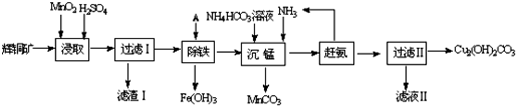
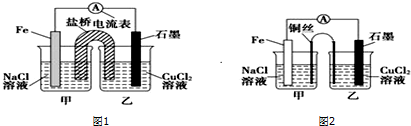
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com