
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2.335 0 g样品,配制成100.00 mL溶液A;②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;③另取25.00 mL溶液A,加足量的NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”、“偏低”或“不变”)。
(2)氨气常用________检验,现象是______________________________________________。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
答案 (1)偏高
(2)湿润的红色石蕊试纸 试纸颜色由红变蓝
(3)n(Ni2+)=0.040 00 mol·L-1×31.25 mL×10-3 L·mL-1=1.250×10-3 mol
n(NH )=
)=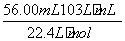
=2.500×10-3 mol
n(SO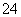 )=
)=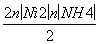
=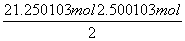
=2.500×10-3 mol
m(Ni2+)=59 g·mol-1×1.250×10-3 mol=0.073 75 g
m(NH )=18 g·mol-1×2.500×10-3 mol=0.045 00 g
)=18 g·mol-1×2.500×10-3 mol=0.045 00 g
m(SO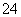 )=96 g·mol-1×2.500×10-3 mol=0.240 0 g
)=96 g·mol-1×2.500×10-3 mol=0.240 0 g
n(H2O)=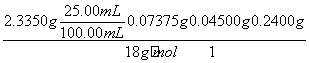
=1.250×10-2 mol
x∶y∶m∶n=n(NH )∶n(Ni2+)∶n(SO
)∶n(Ni2+)∶n(SO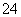 )∶n(H2O)=2∶1∶2∶10
)∶n(H2O)=2∶1∶2∶10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O。
解析 (1)若滴定管使用前没有用EDTA标准溶液润洗,会造成EDTA溶液浓度减小,使消耗的EDTA溶液体积偏大,则测得的Ni2+含量偏高。(2)氨气是中学化学中唯一的碱性气体,常用湿润的红色石蕊试纸检验,试纸由红色变蓝色。


科目:高中化学 来源: 题型:
下列各组元素的原子间容易形成离子键的是( )
| 原子 | a | b | c | d | e | f | g |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
A.a和c B.a和f
C.d和g D.e和g
查看答案和解析>>
科目:高中化学 来源: 题型:
求下列常温条件下溶液的pH(已知lg1.3=0.1,lg2=0.3,混合溶液忽略体积的变化)。
(1)0.005 mol·L-1的H2SO4溶液
(2)0.1 mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度=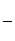 ×100%)
×100%)
(4)将pH=8的NaOH与pH=10的NaOH溶液等体积混合
(5)常温下,将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合
(6)将pH=3的HCl与pH=3的H2SO4等体积混合
(7)0.001 mol·L-1的NaOH溶液
(8)pH=2的盐酸与等体积的水混合
(9)pH=2的盐酸加水稀释到1 000倍
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”、“偏低”或“无影响”填空。
(1)酸式滴定管未用标准溶液润洗( )
(2)锥形瓶用待测溶液润洗( )
(3)锥形瓶洗净后还留有蒸馏水( )
(4)放出碱液的滴定管开始有气泡,放出液体后气泡消失( )
(5)酸式滴定管滴定前有气泡,滴定终点时气泡消失( )
(6)部分酸液滴出锥形瓶外( )
(7)酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)( )
(8)酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)( )
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( )
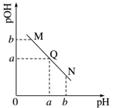
A.M点所示溶液的导电能力强于Q点
B.N点所示溶液中c(CH3COO-)>c(Na+)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.常温下,某溶液中由水电离出的c(H+)=1×10-amol·L-1,若a>7时,则该溶液的pH一定为14-a
B.pH=9的CH3COONa溶液和pH=9的NH3·H2O溶液,两溶液中水的电离程度相同
C.温度一定时,向水中滴加少量酸或碱形成稀溶液,水的离子积常数Kw不变
D.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
查看答案和解析>>
科目:高中化学 来源: 题型:
锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________________(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式:________________________________________________________________________________________________________________________________________________。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式:________________________________________________________________________________________________________________________________________________。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:_____________________________________________________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com