
| A、2s22p2 和2s22p4 |
| B、3s23p4 和2s22p4 |
| C、3s2 和2s22p5 |
| D、3s1 和3s23p4 |


科目:高中化学 来源: 题型:
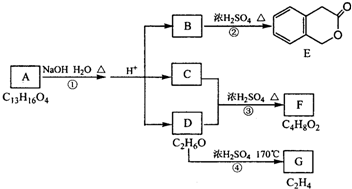
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所消耗的铜的质量相等 |
| B、所消耗的硝酸的量:②>①>③ |
| C、对环境造成的危害,③最小 |
| D、制取硝酸铜的最佳方案是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.1 g镁铝合金中含有镁、铝的质量分别为2.4 g、2.7 g |
| B、溶解5.1 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
| C、生成白色沉淀的最大质量为13.6 g |
| D、若白色沉淀只有Mg(OH)2,该NaOH溶液的物质的量浓度至少为1.2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | ||
| M |
查看答案和解析>>
科目:高中化学 来源: 题型:
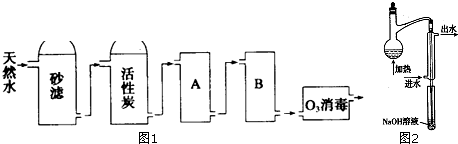
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体一定没有甲烷 |
| B、混合气体中一定是甲烷和乙烯 |
| C、混合气体中一定没有乙烷 |
| D、混合气体中一定有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏属物理变化,煤的干馏和石油裂化、裂解均属于化学变化 |
| B、豆科作物根瘤菌将含氮化合物转化为蛋白质是氮的固定 |
| C、乙醛、葡萄糖与新制的Cu(OH)2悬浊液共热,都产生红色沉淀 |
| D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com