
 ��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����
��2L�ܱ������ڣ�800��ʱ��Ӧ��2NO��g��+O2��g��?2NO2��g����ϵ�У�n��NO����ʱ��ı仯�����| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| ���� | HNO2 | HClO | H2CO3 | H2SO3 |
| ����ƽ�ⳣ�� ��25�棩 | Ki=5.1��10-4 | Ki=2.98��10-8 | $\begin{array}{l}{K_{i1}}=4.3��{10^{-7}}\\{K_{i2}}=5.6��{10^{-11}}\end{array}$ | $\begin{array}{l}{K_{i1}}=1.54��{10^{-2}}\\{K_{i2}}=1.02��{10^{-7}}\end{array}$ |
���� ��1��ƽ�ⳣ����ָ��һ���¶��£����ܷ�Ӧ����ƽ��ʱ��������Ũ��ϵ�����ݳ˻��뷴Ӧ��Ũ��ϵ�����ݳ˻��ıȣ����¶�����ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ���
��2��NO2�Dz���淴Ӧ����Ũ������ƽ��ʱ��c��NO2��=��c��NO����
����v=$\frac{��c}{��t}$����v��NO��������������֮�ȵ��ڻ�ѧ������֮�ȼ���v��O2����
��3������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٸı䣬�ɴ�������һЩ������Ҳ���䣻
��4��a����ʱ�����NO2��Ӧ���ʼ�С��
b���ʵ������¶ȣ�ƽ�����淴Ӧ�����ƶ���
c������O2��Ũ�ȣ���Ӧ����������ƽ��������Ӧ�����ƶ���
d��ѡ���Ч������Ӱ��ƽ���ƶ���
��5����ͬ�����£�����ĵ���ƽ�ⳣ��Խ��������ĵ���̶�Խ��������Խǿ��
��6������ǿ����ȡ�����жϣ�
��7�������£�pH=3��HNO2��Һ��pH=11��NaOH��Һ�У�HNO2Ũ�ȴ����������ƣ����ߵ������ϣ�HNO2����������Һ�����ԣ��ٽ�ϵ���غ��ж�����Ũ�ȴ�С��
��� �⣺��1����Ӧ2NO��g��+O2��g��?2NO2��g����ƽ�ⳣ������ʽK=$\frac{c{\;}^{2}��NO{\;}_{2}��}{c{\;}^{2}��NO����c��O{\;}_{2}��}$�����¶�����ƽ�ⳣ����С��˵�������¶�ƽ�������ƶ�����������Ӧ�Ƿ��ȷ�Ӧ��
�ʴ�Ϊ��$\frac{c{\;}^{2}��NO{\;}_{2}��}{c{\;}^{2}��NO����c��O{\;}_{2}��}$���ţ�
��2��NO2�Dz���淴Ӧ����Ũ������ƽ��ʱ��c��NO2��=��c��NO��=$\frac{0.02mol-0.007mol}{2L}$=0.0065mol/L������ͼ�б�ʾNO2�仯��������b��
2s����NO��ʾ��ƽ����Ӧ����v��NO��=$\frac{\frac{0.02mol-0.008mol}{2L}}{2s}$=3.0��10-3mol•L-1•s-1������֮�ȵ��ڻ�ѧ������֮�ȣ�����v��O2��=$\frac{1}{2}$v��NO��=1.5��10-3mol•L-1•s-1��
�ʴ�Ϊ��b��1.5��10-3mol•L-1•s-1��
��3��a����v ��NO2��=2v ��O2��ʱ��δָ�����淴Ӧ���÷�Ӧ��һ���ﵽƽ��״̬���ʴ���
b���÷�Ӧ��һ����Ӧ������������ı�Ŀ��淴Ӧ�����ﵽƽ��״̬ʱ�������ʵ�Ũ�Ȳ��䣬��������ѹǿ���ֲ��䣬����ȷ��
c����Ϊ��Ӧ����֮�ȵ���ϵ��֮�ȣ���v����NO��=2v�� ��O2��=2v�� ��O2��ʱ���÷�Ӧ�ﵽƽ��״̬������ȷ��
d�����������غ㶨��֪�����������ʼ�ղ��䣬������������䣬�������ڻ��������ܶ�ʼ�ղ��䣬���Բ��ܾݴ��ж��Ƿ�ﵽƽ��״̬���ʴ���
��ѡbc��
��4��a����ʱ�����NO2���壬ƽ��������Ӧ�����ƶ�������Ӧ���ʼ�С����a����
b���ʵ������¶ȣ���Ӧ��������ƽ�����淴Ӧ�����ƶ�����b����
c������O2��Ũ�ȷ�Ӧ���������Ҹ÷�Ӧ������Ӧ�����ƶ�����c��ȷ��
d��ѡ���Ч����������Ӧ���ʣ���ƽ�ⲻ�ƶ�����d����
��ѡ��c��
��5����ͬ�����£�����ĵ���ƽ�ⳣ��Խ��������ĵ���̶�Խ��������Խǿ����KiֵԽ������Խǿ���ʴ�Ϊ��KiֵԽ������Խǿ��
��6������ǿ����ȡ����֪��
A������������Դ���̼��������Ӷ�С��̼�ᣬ���Դ���������Ӻ�̼�ᷴӦ���ɴ������̼��������ӣ���A����
B��HNO2���Դ���̼�ᣬ����2HNO2+CO32-��2NO2-+H2O+CO2���ܷ�������B��ȷ��
C��̼������Դ���������������Ӷ�С�������ᣬ�����������̼������ӷ�Ӧ���ɶ�����̼��ˮ��������������ӣ���C����
D������������Դ���̼��������Ӷ�С�����ᣬ���̼���ƹ����������ķ�ӦΪCl2+H2O+2CO32-��2HCO3-+Cl-+ClO-�ܷ�������D��ȷ��
��ѡ��BD��
��7�������£�pH=3��HNO2��Һ��pH=11��NaOH��Һ�У�HNO2Ũ�ȴ����������ƣ����ߵ������ϣ�HNO2����������Һ�����ԣ���c��H+����c��OH-������Һ�д��ڵ���غ�c��Na+��+c��H+��=c��NO2-��+c��OH-��������c��NO2-����c��Na+��������Һ��HNO2�ĵ���̶Ƚ�С������c��Na+����c��H+���������Һ������Ũ�ȴ�С˳����c��NO2-����c��Na+����c��H+����c��OH-�����ʴ�Ϊ��c��NO2-����c��Na+����c��H+����c��OH-����
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧƽ�ⳣ������Ӧ���ʼ�����Ӱ�����ء�������ʵĵ��롢����Ũ�ȴ�С�ıȽϵ�֪ʶ�㣬�ѶȲ���ע��Ի���֪ʶ���������գ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
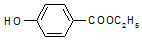
 ��Ҫ��д��298K��101kPaʱ���з�Ӧ���Ȼ�ѧ����ʽ��
��Ҫ��д��298K��101kPaʱ���з�Ӧ���Ȼ�ѧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������������ͼ��
������������ͼ��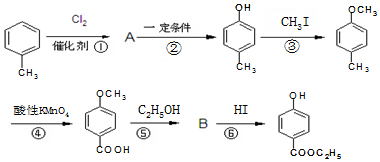
 ��
�� ��-X��-YΪȡ�������Ƕ��ǻ�������������ͬ���칹�����ܷ���������Ӧ����-X�Ľṹ��ʽ������-OH��-CH2OH ��-OCH3��
��-X��-YΪȡ�������Ƕ��ǻ�������������ͬ���칹�����ܷ���������Ӧ����-X�Ľṹ��ʽ������-OH��-CH2OH ��-OCH3���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com