

分析 (1)上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,以此分析;
(2)长周期为四、五、六、七周期;c、d分别为Na、Mg,金属性强的对应最高价氧化物水化物碱性强;i为Zn,原子序数为30;
(3)f为S,位于第三周期第ⅥA族,质子数为16,相对原子质量为32.
解答 解:(1)上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图: ,
,
故答案为: ;
;
(2)长周期为四、五、六、七周期,由图可知,a为H、b为C、c为Na、d为Mg、e为Al、f为S、g为Ar为短周期元素,H、C、Na、Mg、Al、S为主族元素,g为Ar,位于第三周期零族;、d两元素最高价氧化物对应水化物中,碱性较强的是NaOH,i元素是i为Zn,位于第四周期IIB族,为金属元素,
故答案为:H、C、Na、Mg、Al、S、Ar;H、C、Na、Mg、Al、S;NaOH;金属元素;
(3)f为S,位于第三周期第ⅥA族,质子数等于原子序数为16,相对原子质量为32,名称为硫,如图为 ,
,
故答案为:第三周期第ⅥA族; .
.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | F、Cl、Br、I最高正化合价都为+7 | |
| B. | 卤族元素的单质只有氧化性 | |
| C. | 从F到I,原子的得电子能力依次减弱 | |
| D. | 卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
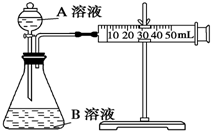 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A | B |
| 1 | 2ml0.1mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 2 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液 |
| 3 | 2ml0.2mol/LH2C2O4溶液 | 4ml0.01mol/LKMnO4溶液和少量MnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①② | C. | ①②④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q=197KJ | B. | Q<197×2 KJ | C. | Q<197KJ | D. | Q>197KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
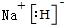 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、CsCl、CF4、CBr4 | B. | CsCl、SiO2、CBr4、CF4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com