
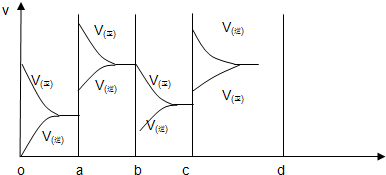
(1)��ͼ��ʾ���ܱ������з�Ӧ��2A(g)��3B(g)![]() C(g)��4D(s)����H��0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a��b�����иı�����������ǣ�________��b��c�����иı������������________��������ѹǿʱ����Ӧ�ٶȱ仯�������c��d����
C(g)��4D(s)����H��0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a��b�����иı�����������ǣ�________��b��c�����иı������������________��������ѹǿʱ����Ӧ�ٶȱ仯�������c��d����

(2)(8��)��Ӧ2A![]() B��C����ijһ�¶�ʱ���ﵽƽ��
B��C����ijһ�¶�ʱ���ﵽƽ��
�����¶����ߣ���ѧƽ�ⳣ����С��������Ӧ��________�ȷ�Ӧ��
����B�ǹ��壬����ѹǿʱ��ƽ�������ƶ�����A��________̬��
����A����̬����ѹʱ��ƽ�ⲻ�ƶ�����BΪ________̬��CΪ________̬

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
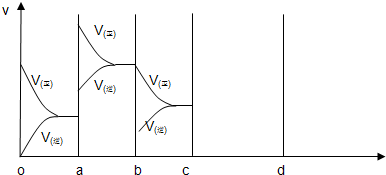
��1����4�֣���ͼ��ʾ���ܱ������з�Ӧ��2SO2+O22SO3 ��H<0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����ab�����иı������������ ��bc�����иı������������ ��
��2����3�֣���֪���������Ȼ�ѧ����ʽ��
H2(g)��O2(g) �� H2O(l ) ��H����285.8 kJ��mol��1
C3H8(g)��5O2(g) �� 3CO2(g)+4H2O(l) ��H����2220.2 kJ��mol��1
ʵ����H2��C3H8�Ļ�����干5mol����ȫȼ������Һ̬ˮʱ����3847kJ������������H2��C3H8���������
��3������3�֣�ʵ���ҽ��е���Ȼ�����Һʱ���������ռ���4.48L���壨����������跴Ӧ����Һ�������Ϊ200ml���������Һ���������Ƶ����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��2011ѧ�������ʡ��һ�и�һ��ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��1����4�֣���ͼ��ʾ���ܱ������з�Ӧ��2SO2+O2 2SO3 ��H<0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����ab�����иı������������ ��bc�����иı������������ ��
2SO3 ��H<0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����ab�����иı������������ ��bc�����иı������������ ��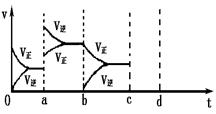
��2����3�֣���֪���������Ȼ�ѧ����ʽ��
H2(g)�� O2(g) �� H2O( l ) ��H����285.8 kJ��mol��1
O2(g) �� H2O( l ) ��H����285.8 kJ��mol��1
C3H8(g)��5O2(g) �� 3CO2(g) +4H2O(l) ��H����2220.2 kJ��mol��1
ʵ����H2��C3H8�Ļ�����干5mol����ȫȼ������Һ̬ˮʱ����3847kJ������������H2��C3H8���������
��3������3�֣�ʵ���ҽ��е���Ȼ�����Һʱ���������ռ���4.48L���壨����������跴Ӧ����Һ�������Ϊ200ml���������Һ���������Ƶ����ʵ���Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��㶫ʡ�����и߶���ѧ�����п��Ի�ѧ�������Ծ� ���ͣ������
��1���������з�Ӧ��2SO2
+ O2  2SO3 �� ���2min��SO2��Ũ����6 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____________����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________��
2SO3 �� ���2min��SO2��Ũ����6 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____________����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________��
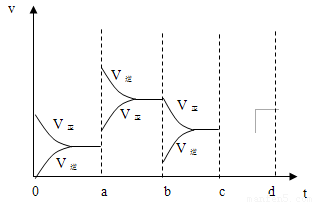
��2����ͼ��ʾ���ܱ������з�Ӧ��2SO2+O2 2SO3 ��H<0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������
��b c�����иı������������
�� ������ѹǿʱ����Ӧ�ٶȱ仯�������c~d��.
2SO3 ��H<0�ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������
��b c�����иı������������
�� ������ѹǿʱ����Ӧ�ٶȱ仯�������c~d��.
(3)���û�ѧƽ���ƶ�֪ʶ���;��õ���ˮ(�����dz��ڷ����ڼ����),���dz��ɫ��ʧ,��Һ���ϡ����:
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com