
| A. | C6H5NH2 | B. | C6H5OH | C. | C6H5 CH2OH | D. | C6H5CH2 CH3 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,同系物必须是同一类物质(含有相同且数量相等的官能团).
解答 解:A.C6H5NH2含有氨基,结构不相似,不是同系物,故A错误;
B.C6H5OH含有羟基,属于酚类,结构不相似,不是同系物,故B错误;
C.C6H5 CH2OH含有羟基,属于醇类,结构不相似,不是同系物,故C错误;
D.C6H5CH2 CH3与C6H6,结构相似,在分子组成上相差2个CH2原子团,互为同系物,故D正确;
故选D.
点评 本题考查了同系物的判断,题目难度不大,注意掌握同系物的概念及判断方法,明确互为同系物的有机物分子一定具有相似结构:如果含有官能团,则含有的官能团的种类及数目一定相同.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q3<Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
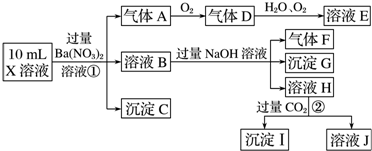
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
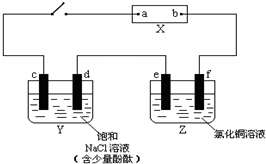
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
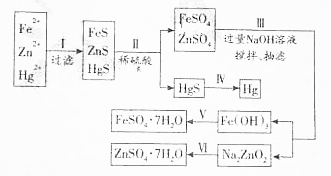
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴水中通入适量的SO2:Br2+SO2+2H2O═2Br-+SO${\;}_{4}^{2-}$+4H+ | |
| B. | 用铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 向明矾溶液中滴加过量氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH${\;}_{4}^{+}$+2H2O | |
| D. | 向小苏打溶液中加少量Ba(OH)2溶液:HCO${\;}_{3}^{-}$+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com