
【题目】已知3.25g金属Zn恰好与250mL某浓度的盐酸完全反应,计算:
(1)该盐酸的物质的量浓度;___________
(2)标准状况下,该反应生成的气体的体积。_____________
科目:高中化学 来源: 题型:
【题目】用电镀锡渣(主要含![]() 、
、![]() )联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:
)联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:

已知:①![]() 易水解生成碱式氯化亚锡
易水解生成碱式氯化亚锡![]() ;②在水溶液中,
;②在水溶液中,![]() 易被氧化为
易被氧化为![]() 。
。
请回答下列问题:
(1)锡在周期表中的位置为___________。
(2)已知反应I得到的沉淀是![]() ,产生气体的结构式为_____,反应的化学方程式为_______。
,产生气体的结构式为_____,反应的化学方程式为_______。
(3)图中滤液的主要成分为_______________、_______________(写化学式)。
(4)酸溶时一般加入浓盐酸进行溶解,请用化学方程式及必要文字解释原因:______________。
(5)电镀锡渣中的锡与烧碱、硝酸钠溶液反应可生产锡酸钠,并产生一种碱性气体,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是________.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是 ______。

(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中,向第1支试管中滴加适量氨水出现白色沉淀___________(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是______。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有___ 性.
(5)装置D的作用是______。
(6)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是
A. 0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+Al(OH)3↓+NH3·H2O
B. 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C. H2(g)+![]() O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
O2(g)═H2O(g)△H=﹣285.8kJ·mol﹣1,则H2的燃烧热为285.8 kJ·mol﹣1
D. CO(g)的燃烧热是283.0 kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以左右自由滑动的隔板(其质量忽略不计).其中能表示相同温度时,等质量的氢气与氦气的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究发现硼氢化钠(NaBH4)在催化剂Ru表面与水反应可生成H2,其反应机理如图所示:
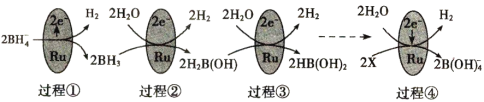
根据以上信息判断,下列叙述错误的是
A.过程①至过程④中硼元素的化合价不变
B.X是H3BO3,H3BO3和BH3两分子中H的化合价相等
C.过程③和过程④各产生1molH2时转移的电子数不相等
D.0.25molNaBH4的还原能力与标准状况下22.4LH2的还原能力相当(还原能力即生成H+失去电子的量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:下列说法正确的是( )
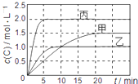
容器 | 甲 | 乙 | 丙 |
容积 | 0.5L | 0.5L | 1.0L |
温度 | T1 | T2 | T2 |
反应物起始量 | 0.5molA 1.5molB | 0.5molA 1.5molB | 2.0molA 6.0molB |
A.由图可知:T1<T2,且该反应为吸热反应
B.T2时该反应的平衡常数K=0.8
C.物质A的化学计量数x=2
D.保持甲容器体积不变,向其中通入He气体,达到新平衡后,C的百分含量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CO2及氮氧化物的研究有更大意义:
(1)CO2与H2可用来合成可再生能源甲醇,已知CH3OH(l)标准燃烧热△H=-726.5kJ/mol、H2的燃烧热数值为285.8kJ/mol,则CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=___。
CH3OH(l)+H2O(l) △H=___。
(2)用NH3催化还原NOx时包含以下反应。
反应I:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H1<0
5N2(g)+6H2O(l) △H1<0
反应Ⅱ:4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g) + 6H2O(l) △H2>0
5N2(g)+3O2(g) + 6H2O(l) △H2>0
反应Ⅲ:2NO(g) +O2(g)![]() 2NO2(g) △H3<0
2NO2(g) △H3<0
① 反应I在容积固定密闭容器内进行,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法正确的是___。
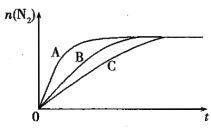
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
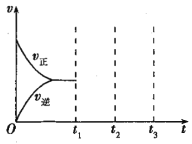
②将物质的量之比为2:1的NO、O2混合气体置于恒温密闭容器中发生反应Ⅲ,正、逆反应速率随时间变化曲线如图所示。在t1时,保持容器压强不变,充入一定量的NO2,t2时建立新的平衡,请在答题纸中画出t1~t3正、逆反应速率随时间变化曲线。___
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
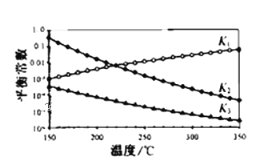
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。则△H2__△H3(填“大于”、“小于”、“等于”),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据电化学知识,解决下列问题:
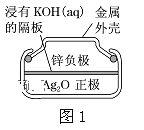
(1)图1为锌银电池,负极是Zn,正极是Ag2O,电解质是KOH。写出该电池负极电极反应式:___,电池工作时,正极区周围溶液的pH___(填“增大”、“减小”、“不变”)。
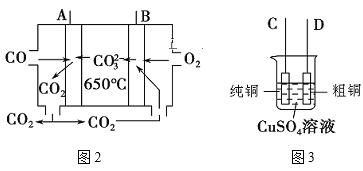
(2)图2是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,图3是粗铜精炼的装置图,现用该燃料电池为电源进行粗铜的精炼实验。
①写出A极的电极反应式:___。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与__极(填“C”或“D”)相连。
③当消耗标准状况下2.24LO2时,C电极的质量变化为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com