
| A. | 向碳酸钠溶液中加入过量醋酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 向偏铝酸钠溶掖中通入过量二氧化碳;CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 向莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液中加入过量氧氧化钠溶液:NH4++Fe2++3OH-═NH3•H2O+Fe(OH)2↓ | |
| D. | 向双氧水中加入酸性高锰酸钾溶液:5H2O2+2MnO4-═2Mn2++5O2↑+6OH-+2H2O |
分析 A.碳酸钠与醋酸反应生成醋酸钠、二氧化碳气体和水,醋酸为弱电解质,离子方程式中需要保留分子式;
B.向偏铝酸钠溶液中通入过量的二氧化碳气体生成氢氧化铝和碳酸氢钠;
C.离子方程式中铵根离子、亚铁离子比不符合莫尔盐的组成;
D.反应中氧元素化合价由-1升高为0价,Mn元素化合价由+7价降低为+2,酸性条件不可能生成氢氧根离子.
解答 解:A.CH3COOH为弱酸,在离子方程式中应写成化学式,其反应的离子方程式为:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO-,故A错误;
B.碳酸的酸性强于氢氧化铝,向偏铝酸钠溶液中通入过量的二氧化碳气体生成氢氧化铝和碳酸氢钠,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故B正确;
C.向莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液中加入过量氧氧化钠溶液:2NH4++Fe2++4OH-═2NH3•H2O+Fe(OH)2↓,故C错误;
D.酸性高锰酸钾溶液中滴加双氧水反应为:2Mn04-+5H2O2+6H+=2Mn2-+5O2↑十8H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的规范答题能力.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
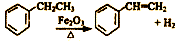 下列说法中错误的是( )
下列说法中错误的是( )| A. | 可用溴的四氯化碳来鉴别乙苯和苯乙烯 | |
| B. | 乙苯分子中所有原子可能都处于同一平面 | |
| C. | 苯乙烯可发生氧化反应、取代反应、加成反应 | |
| D. | 乙苯与苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
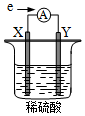 在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )
在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )| A. | 外电路中电流方向为:X→ →Y →Y | |
| B. | 若两电极分别为铁棒和碳棒,则 X 为碳棒,Y 为铁棒 | |
| C. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 | |
| D. | 若两电极都是金属单质,则它们的活动性顺序为 X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
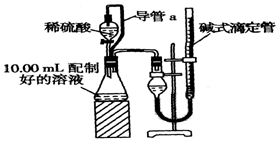 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B可以从溶液中置换出C单质 | |
| B. | 简单离子半径:D>A>B>C | |
| C. | A和D形成的化合物溶于水可导电,所以该化合物为电解质 | |
| D. | 最高价氧化物对应的水化物的酸性:A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com