
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )
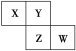
A. W的氧化物对应的水化物是强酸B. 原子半径:X﹥Y
C. Z单质氧化性强于Y单质D. X的氢化物的水溶液呈酸性
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈
B. 标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移电子数为2mol
C. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g)![]() CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g)![]() CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
CH3OCH3(g)+CO2(g) △H=____kJ·mol-1。
下列措施中,能提高CH3OCH3产率的有____。
A.使用合适的催化剂 B.升高温度 C.增大压强
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是____。
A.△H < 0
B.P1<P2<P3
C.若在P3和316℃时,起始n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%

(3)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(4)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,b电极的电极反应式为____。
(5)甲醇液相脱水法制二甲醚的原理是:
CH3OH +H2SO4 → CH3HSO4+H2O,
CH3 HSO4+CH3OH → CH3OCH3+H2SO4。
与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能够大量共存的是
A.Na+、OH-、SO42-、Fe3+B.K+、SO42-、CO32-、H+
C.Na+、Ca2+、Cl-、CO32-D.Ba2+、Na+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是
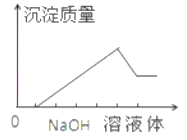
A. Mg2+、Al3+、Fe3+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,产物中只能生成铁的+3价化合物的是
A.少量铁与稀硫酸反应
B.铁丝在氧气中燃烧
C.少量FeCl2溶液中通入过量氯气
D.Fe投入到CuSO4溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:

已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸汽在标准状况下密度为2.5g·L-1;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
② 其中R为烃基
其中R为烃基
③ 其中R1和R2均为烃基
其中R1和R2均为烃基
回答下列问题:
(1)A的结构简式为________________________________;
(2)反应④的化学方程式为_________________________________;
(3)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有______________种;
(4)反应①~⑦属于取代反应的是________________________(填序号);
(5)反应⑦的化学方程式为________________________________;
(6)参照上述合成路线,以  为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料 ________________________。
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH-H键吸收的能量为436KJ,形成1molH-N键放出的能量为391KJ,根据化学方程式N2+3H2![]() 2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
A.431KJ B.649KJ C.869KJ D.945.6KJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com