
| A.Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S═CuS↓+2H+ |
| C.Zn2++S2-+2H2O═Zn(OH)2↓+H2S↑ |
| D.FeS+2H+═Fe2++H2S↑ |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热胆矾失去结晶水的过程称风化 |
| B.在饱和溶液中,溶质溶解的速率等于结晶速率 |
| C.从溶液中结晶析出的晶体都含有结晶水 |
| D.从冰箱中取出一瓶可乐,表面出现水珠,这种现象是潮解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.RCl>RI>R2CrO4 | B.RCl>R2CrO4>RI |
| C.R2CrO4>RCl>RI | D.R2CrO4>RI>RCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| O | 2-3 |
| O | 2-6 |
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等体积混合浓度均为0.2mol?L-1的AgNO3溶液和CH3COONa溶液一定不产生CH3COOAg沉淀 |
| B.将0.001mol?L-1的AgNO3溶液滴入0.001mol?L-1的KCl和0.001mol?L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 |
| C.在Mg2+为0.12mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上 |
| D.向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 2-3 |
| A.x数值为2×10-5 |
| B.c点时有碳酸钙沉淀生成 |
| C.加入蒸馏水可使溶液由d点变到a点 |
| D.b点与d点对应的溶度积相等 |
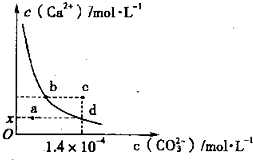
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2ZnO,下列判断正确的是( )
2ZnO,下列判断正确的是( )| A.放电时,OH-向负极方向移动 |
B.放电时,正极反应式为Zn+2OH--2e- ZnO+H2O ZnO+H2O |
| C.充电时,Zn发生氧化反应 |
D.充电时,阴极反应为O2+2H2O+4e- 4OH- 4OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水的离子积KW随温度、外加酸(碱)浓度的改变而改变 |
| B.难溶电解质作比较时,Ksp小的溶解度一定小 |
| C.对已达平衡的反应,仅改变浓度,若平衡移动,则平衡常数(K)一定改变 |
| D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com