
请按要求填空:
(1)下列实验操作或对实验事实的叙述正确的是________(填序号).
①用稀HNO3清洗做过银镜反应实验的试管
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
③用碱式滴定管量取20.00 mL 0.100 0 mol/L的KMnO4溶液
④用托盘天平称取10.50 g干燥的NaCl固体
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸
(2)为了确定乙醇分子的结构简式是CH3-O-CH3还是CH3CH2OH,实验室利用图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目.试回答下列问题:

①指出实验装置中的错误________.
②若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得的氢气体积将________(填“偏大”“偏小”或“不变”).
③请指出能使该实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)________.
|
答案:(1)①②⑤⑧ (2)①广口瓶中进气导管不应插入水中,排水导管应插至广口瓶底部,量筒中导管末端不应插入液面以下 ②偏大 ③检查实验装置的气密性;加入稍过量金属钠;从漏斗中缓慢滴加无水乙醇 解析:(1)KMnO4具有强氧化性,可氧化橡胶管,故不能用碱式滴定管量取KMnO4溶液;托盘天平的最小分度值为0.1 g,不能称量准确至0.01 g的样品;瓷坩埚成分中含有SiO2可与Na2CO3等碱性物质在高温下反应;由胶体的制备原理可知,应向沸水中加入FeCl3饱和溶液制备胶体,而向碱液中加入FeCl3时只会生成Fe(OH)3沉淀,本题答案应为①②⑤⑧;(2)要通过测量排出水的体积确定产生H2的体积,广口瓶中的进气导管不能伸入到液面以下,而排出水导管应伸入到广口瓶底部.由于等质量的水和乙醇,水的物质的量大于乙醇,与金属钠作用时,产生H2的物质的量增大,故用含水乙醇代替无水乙醇时,所得H2体积偏大.要使该实验安全顺利进行,首先要保证该装置不能漏气,为使排出水的体积等于产生氢气的体积,则乙醇的加入速度不能太快,为确保定量乙醇完全反应,金属钠应稍过量. |
|
本题综合考查有关实验的安全性操作、仪器的精度及误差分析等内容. |


 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
(1)下列实验操作或对实验事实的叙述正确的是______(填序号)。
①用稀HNO3清洗做过银镜反应实验的试管;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③用碱式滴定管量取20.00 mL 0.1000 mol·L-1KMnO4溶液;
④用托盘天平称取10.50 g干燥的NaCl固体;
⑤不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧配制Al2(SO4)3溶液时,加入少量的稀硫酸。
(2)为了确定乙醇分子的结构简式是CH3—O—CH3?还是CH3CH2OH,实验室利用图2-3所示的实验装置,测定乙醇与钠反应(ΔH<0=生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目。试回答下列问题:

图2-3
①指出实验装置中的错误________________。
②若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得的氢气体积将_______(填“偏大”“偏小”或“不变”)。
③请指出能使该实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)。
查看答案和解析>>
科目:高中化学 来源: 题型:
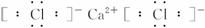
请按要求填空:
(1)E的电子式是_______________,B中含有的化学键类型有_______________。
(2)反应②的化学方程式是_____________________________________________。
(3)反应①在工业上有重要的用途,其化学方程式是______________________________。
(4)取一试管A气体倒置于水槽中光照足够长的时间,(假设溶质不扩散到试管外,气体体积按标准状况下计算)所得溶液的物质的量浓度为______________________________。
(5)G为一元弱酸,设G的化学式为HX,常温下如果取0.1 mol·L-1HX溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液总体积等于两溶液体积之和),测得混合溶液的pH=8。
求出混合溶液中下列算式的精确计算结果:
c(Na+)-c(X-)=__________________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分) 现有A、B、C、D四种有机物,已知:
①它们的相对分子质量都是104;
②A是芳香烃,B、C、D均为烃的含氧衍生物,分子内均没有甲基;
③A、B、C、D能发生如下反应生成高分子化合物X、Y、Z(方程式未注明条件):
nA→X nB→Y(聚酯)+nH2O nC+nD→Z(聚酯)+(2n-1)H2O
请按要求填空:
(1)A的结构简式是______________;
(2)B也能发生分子内酯化生成五元环状化合物E,E的结构筒式是______________;
(3)Z的结构简式是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示各物质之间的转化关系,已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
请按要求填空:
(1)写出B的电子式__________________________。
(2)写出生成E的电极反应式: ___________________________________。
反应⑤的现象是_______________________________。
(3)反应①的化学方程式是__________________________。
在实验室中引发反应④的操作是______________________。
(4)反应⑥中若转移1 mol电子,则被还原的X是_____________mol。
查看答案和解析>>
科目:高中化学 来源:2013届江西省南昌十九中高三第二次(10月)化学试卷(带解析) 题型:填空题
(10分)下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C。 H可用作工业上冶炼金属的还原剂。请按要求填空:
(1)写出下列物质的化学式:A:________;B:________;C:________.
(2)写出F+B→I的化学方程式_________________________________.
(3)写出G和I的浓溶液反应的化学方程式_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com