
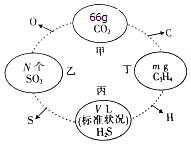
 如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同.(设NA为阿伏伽德罗常数的值)
如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同.(设NA为阿伏伽德罗常数的值)分析 66g二氧化碳物质的量为$\frac{66g}{44g/mol}$=1.5mol,1.5molCO2中含有1.5molC和3molO,结合n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{Vm}$计算.
解答 解:66g二氧化碳物质的量为$\frac{66g}{44g/mol}$=1.5mol,1.5molCO2中含有1.5molC和3molO.
(1)已知1.5molCO2中含有1.5molC和3molO,甲和乙中的O原子个数相同,则SO3中O原子为3mol,所以SO3的物质的量为1mol,即N=NA;乙丙中S原子数相同,所以丙中H2S的物质的量为1mol,在标准状况下体积为22.4L;
故答案为:NA;22.4;
(2)甲中二氧化碳物质的量为1.5mol,丙中硫化氢物质的量为1mol,所以二者物质的量之比为:3:2;
故答案为:3:2;
(3)乙中含有三氧化硫物质的量为1mol,原子个数为4NA;甲丁中C原子数相同,则C3H4的物质的量为0.5mol,原子个数为0.5mol×7×NA=3.5NA,乙中SO3和丁中C3H4的原子个数之比:4:3.5=8:7,
故答案为:8:7.
点评 本题考查了物质的量的计算,题目难度不大,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,试题有利于培养学生灵活应用所学知识的能力.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:解答题
 现有16.4克O2和CO2的混合气体,在标准状况下其体积为8.96L.请回答下列问题:
现有16.4克O2和CO2的混合气体,在标准状况下其体积为8.96L.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子组成相差一个或若干个CH2原子团的有机物是同系物 | |
| B. | 乙酸的官能团是羧基,乙醇的官能团是羟基 | |
| C. | 乙烯的产量通常用来衡量一个国家的石油化工发展水平 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水可以鉴别碳酸钠和碳酸氢钠 | |
| B. | 新制氯水经光照一段时间pH减小 | |
| C. | 自然界硅元素贮量丰富,并存在大量的单质硅 | |
| D. | 等质量的碳酸钠与碳酸氢钠分别于足量盐酸反应,产生二氧化碳质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K+、CO32-、SO42- | B. | Fe3+、Na+、NO3-、SO42- | ||
| C. | Mg2+、Ba2+、OH-、NO3- | D. | K+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com