
【题目】某校化学兴趣小组的同学运用滴定法对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定,请回答下列问题:
(1)用分析天平准确称取该样品5.360g,全部溶于水配制成1000.0mL的溶液。用碱式滴定管取其中20.00mL放在锥形瓶中,滴加几滴甲基橙做指示剂。用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视着____。滴定终点的现象是____________。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_____(填写序号)
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,滴定结束时俯视读数
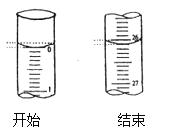
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则滴定终点的读数为____mL。
(4)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | |||
第1次 | 20.00 | 0.00 | 26.01 | |
第2次 | 20.00 | 1.56 | 30.30 | |
第3次 | 20.00 | 0.22 | 26.21 | |
请选用其中合理的数据列式计算出该样品中NaOH的质量百分含量。(写出计算过程)__
【答案】锥形瓶内溶液颜色变化 由黄色变成橙色,且半分钟不褪色 D 26.10 26.00×10-3L×0.1000mol/L×40g/mol×50/5.360g=97.01%
【解析】
(1)滴定时要根据锥形瓶中溶液颜色变化判断终点;溶液为黄色,达到终点时变为橙色;
(2)根据C(待测)═![]() 分析;
分析;
(3)由图可知滴定前读数为0.00mL,滴定后读数为26.10mL;
(4)第二次实验数据误差太大,舍去,求出第一、三次实验的平均值;计算C(待测)═![]() ,再根据C(待测)计算样品中NaOH的质量百分含量。
,再根据C(待测)计算样品中NaOH的质量百分含量。
(1)滴定时要根据锥形瓶中溶液颜色变化判断终点,所以眼睛应该观察锥形瓶内溶液颜色变化;滴定前锥形瓶中为氢氧化钠和甲基橙,溶液为黄色,达到终点时变为橙色,则滴定终点的现象是溶液由黄色变成橙色,且半分钟不褪色;
答案:锥形瓶内溶液颜色变化 由黄色变成橙色,且半分钟不褪色
(2)根据c(待测)═![]() 分析,V(标准)高,则偏高,V(标准)低,则偏低;
分析,V(标准)高,则偏高,V(标准)低,则偏低;
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成消耗的V(标准)偏大,则测定c(NaOH)偏高,故A不符合;
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,测定c(NaOH)无影响,故B不符合;
C.酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,测定c(NaOH)偏高,故C不符合;
D.读取盐酸体积时,滴定结束时俯视读数,造成V(标准)偏小,测定的c(NaOH)偏低,故D符合;
答案:D
(3)由图可知滴定前读数为0.00mL,滴定后读数为26.10mL;
答案: 26.10
(4)第二次实验数据误差太大,舍去,求出第一、三次实验的平均值为![]() =26.00mL,则c(待测)═
=26.00mL,则c(待测)═![]() =
=![]() =0.13mol/L,则1000.0ml溶液中氢氧化钠为n=cV=0.13mol/L×1L=0.13mol,所以m(NaOH)=nM=0.13mol×40g/mol=5.2g,该样品中NaOH的质量百分含量为
=0.13mol/L,则1000.0ml溶液中氢氧化钠为n=cV=0.13mol/L×1L=0.13mol,所以m(NaOH)=nM=0.13mol×40g/mol=5.2g,该样品中NaOH的质量百分含量为![]() ×100%=97.01%;
×100%=97.01%;
计算过程简写: 26.00×10-3L×0.1000mol/L×40g/mol×1000/(20×5.360g)=26.00×10-3L×0.1000mol/L×40g/mol×50/5.360g=97.01%
答案: 26.00×10-3L×0.1000mol/L×40g/mol×50/5.360g=97.01%


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】写出下列有机物的官能团的名称及反应方程式。
(1)①![]() ______ ;②
______ ;②![]() ______;③
______;③![]() ______ ;④
______ ;④![]() ______ ;⑤
______ ;⑤![]() ______ .
______ .
(2)溴乙烷制乙醇:________________________________________________________________
(3)60℃时1,3-丁二烯与溴水发生1,4加成反应________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组设计的用化学电源使LED灯发光,装置如图。下列说法错误的是![]()
![]()
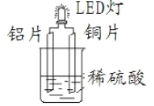
A.铜片表面有气泡生成
B.装置中存在“化学能→电能→光能”的转换
C.如果将铝片换成银片,电路中的电流方向相反
D.如果将硫酸换成NaOH溶液,LED灯也会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有100 mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如下图所示,则:
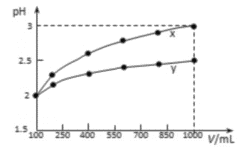
A. x为强酸,y为弱酸
B. 随着稀释的进行,y的电离程度减小
C. 稀释前x、y的物质的量浓度相等
D. 稀释后的x、y分别分别与足量的锌反应,y放出的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是______mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是________,又变为棕黄色的原因是用离子方程式解释___________________________.
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式_________。向反应后的溶液中通入过量CO2,反应的离子方程式为______。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________,反应中生成0.2mol HNO3,转移的电子数目为_______。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向Na2CO3溶液中逐滴滴入0.1mol·L-1盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是( )

A.a点时溶液pH=11.5,原因是:CO32—+2H2O===H2CO3+2OH-
B.a~b段发生反应为:CO32—+2H+===CO2↑+H2O
C.b~c段发生反应为:HCO3—+H+===CO2↑+H2O
D.c~d段发生反应为:H++OH-===H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铜和浓硫酸的反应,下列装置或操作错误的是
甲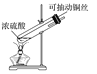 乙
乙 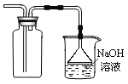 丙
丙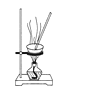
A.上下移动装置甲中的铜丝可控制SO2的生成
B.装置乙可用于收集SO2气体
C.为确认甲中有CuSO4生成,向甲中反应后的试管中直接加水稀释,观察溶液颜色
D.利用装置丙将硫酸铜溶液加热浓缩、冷却结晶,可析出CuSO4·5H2O晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com