
| A. | PbCO3 | B. | SnCO3•Sn(OH)2 | C. | 2PbCO3•Pb(OH)2 | D. | (CH3COO)2Pb |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 把aL0.1mol/L的CH3COOH溶液与bL0.1mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)═c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol/L的NaHCO3溶液与0.3mol/L的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+) | |
| C. | 向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Br | B. | CH3CH2CH2CH2Br | ||
| C. | CH3CHBrCH2Br | D. | BrCH2CH2CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中失去电子的电极为阳极 | |
| B. | 原电池的两极一定是由活动性不同的两种金属组成 | |
| C. | 电解时电解池的阳极一定是阴离子放电 | |
| D. | 原电池的负极、电解池的阳极都发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
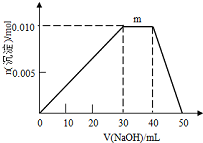 化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
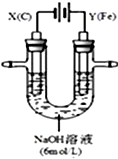 某课外小组分别用如图所示装置对电解原理进行实验探究.
某课外小组分别用如图所示装置对电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③④⑥⑦ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com