
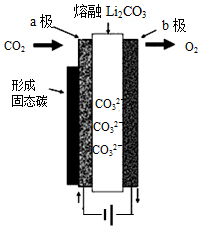
 2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )| A. | 化学能转变为电能 | |
| B. | 阴极的电极反应为:CO2+4e-=C↓+2O2- | |
| C. | 阳极的电极反应为:2CO32--4e-=2CO2↑+O2↑ | |
| D. | 阴极上每通过4mole-,阴极区有1molCO2参与反应 |
分析 由装置图可知为电解池,电能转化成化学能,a极与电源负极相连为阴极,则二氧化碳得电子发生还原反应,反应为:3CO2+4e-=2CO32-+C↓,b极与电源正极相连为阳极发生氧化反应,反应为:2CO32--4e-=2CO2↑+O2↑,据此分析解答.
解答 解:A.由装置图可知为电解池,电能转化成化学能,故A错误;
B.a极与电源负极相连为阴极,则二氧化碳得电子发生还原反应,反应为:3CO2+4e-=2CO32-+C↓,故B错误;
C.b极与电源正极相连为阳极发生氧化反应,反应为:2CO32--4e-=2CO2↑+O2↑,故C正确;
D.由阴极反应为:3CO2+4e-=2CO32-+C↓,则阴极上每通过4mole-,阴极区有3molCO2参与反应,故D错误;
故选C.
点评 本题考查了电解池原理,题目难度中等,正确判断书写阴阳极的反应式为解答关键,注意熟练掌握电解池的工作原理,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:填空题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率增大,逆反应速率减小,平衡向正向移动 | |
| B. | 逆反应速率增大,正反应速率减小,平衡逆向移动 | |
| C. | 正、逆反应速率都增大,平衡不移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子. | |
| B. | 1 mol Fe参与反应失去电子数目一定为2NA | |
| C. | 1 molNA被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰 | B. | 亚硫酸钠(Na2SO3) | C. | 铁粉 | D. | 硫酸亚铁(FeSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2( H2O) | B. | NaOH(Na2O) | C. | CuSO4( CuO) | D. | NaCl( NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| HCN | HF | CH3COOH | HNO2 | |
| Ka | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | CHSCOOH | C. | HF | D. | HNOp |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com