
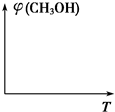
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
分析 (1)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;
(2)①升高温度,可逆反应向吸热反应方向移动,根据平衡常数与温度变化关系确定焓变;
②转化率=$\frac{n(CO)(反应)}{n(CO)(反应开始)}$,根据平衡浓度计算出平衡常数来确定温度;
(3)要提高CO的转化率,必须使可逆反应向正反应方向移动;
(4)根据压强对平衡移动的影响判断;
解答 解:(1)a.无论反应是否达到平衡状态,生成CH3OH的速率与消耗CO的速率始终相等,所以不能作为判断平衡状态的依据,故错误;
b.混合物的质量始终不变,容器的体积不变,所以混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故错误;
c.反应前后,混合气体的物质的量改变,气体的质量不变,反应达到平衡状态时,混合气体的相对平均分子质量不变,所以能作为判断平衡状态的依据,故正确;
d.反应达到平衡状态时,CH3OH、CO、H2的浓度都不再发生变化,所以能作为判断平衡状态的依据,故正确;
故选 cd;
(2)①升高温度,平衡向吸热方向移动,根据表格知,温度越高,化学平衡常数越小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H<0,
故答案为:<;
②平衡时一氧化碳的物质的量=0.2mol/L×2L=0.4mol,转化率=$\frac{n(CO)(反应)}{n(CO)(反应开始)}$=$\frac{(1-0.4)mol}{2mol}$=80%,
CO(g)+2H2(g)?CH3OH(g)单位为mol/L
开始 (mol/L):1mol/L 3mol/L 0
反应(mol/L):0.8mol/L 1.6mol/L 0.8mol/L
平衡(mol/L):0.2mol/L 1.4mol/L 0.8mol/L
平衡常数K=$\frac{0.8mol/L}{0.2mol/L×(1.4mol/L)^{2}}$=2.04,所以是250℃;
故答案为:250℃;80%;
(3)a.该反应是放热反应,升高温度平衡向逆反应方向移动,故错误;
b.催化剂对平衡移动无影响,故错误;
c.增加CO的浓度,平衡向正反应方向移动,但CO的转化率降低,故错误;
d.加入H2加压,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
e.加入惰性气体加压,参加反应的气体压强不变,平衡不移动,故错误;
f.分离出甲醇,平衡向正反应方向移动,一氧化碳的转化率增大,故正确;
故选df;
(4)CO(g)+2H2(g)?CH3OH(g)△H<0,
则温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,则图象为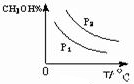 ,
,
故答案为: .
.
点评 本题考查了影响化学平衡移动的因素、平衡状态的判断等知识点,易错选项是(3)C,注意加入CO虽然能使平衡向正反应方向移动,但一氧化碳的转化率降低,为易错点.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 水溶液 |
| 甲醇 | -97 | 64.7 | 互溶 |
| 甲硫醇 | -123 | 6.8 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| D. | 锌铜原电池中,锌做负极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O所含的分子数为NA | |
| B. | 22.4 L H2O所含的分子数为NA | |
| C. | NA个氢原子的质量为2 g | |
| D. | 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| C. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| D. | “血液透析”利用了胶体的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com