
实验室制备硝基苯的主要步骤如下:①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;③在50~60℃下发生反应,直至反应结束;④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯净的硝基苯。
请填写下列空白:
(1)配制一定比例浓硫酸和浓硝酸混合酸时,操作的注意事项是__________________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是____________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是__________________________。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是________。
(5)纯硝基苯是无色,密度比水_____(填“大”或“小”),具有________气味的油状液体。
科目:高中化学 来源: 题型:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。试写出反应的化学方程式:____________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL;若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为: 。
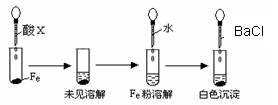 (3)根据下图操作及现象推断酸X为_____(填选项)。 A.浓盐酸 B.浓硫酸 C.浓硝酸
(3)根据下图操作及现象推断酸X为_____(填选项)。 A.浓盐酸 B.浓硫酸 C.浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于实验的说法正确的是
A.用玻璃棒蘸取氯水溶液,滴在pH试纸上,待变色后与比色卡对照,确定氯水的pH
B.滴定用的滴定管、锥形瓶和配制一定物质的量浓度溶液用的容量瓶,使用前均要润洗
C.均不能采取将溶液直接蒸干的方法制得AlCl3、Al2(SO4)3、FeCl3、Fe2(SO4)3
D.因为Ksp (CaCO3)<Ksp(CaSO4),所以可用Na2CO3和HCl除去水垢中的CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
以下说法正确的是( )
A.共价化合物内部可能有极性键和非极性键
B.原子或离子间相互的吸引力叫化学键
C.非金属元素间只能形成共价键
D.金属元素与非金属元素的原子间只形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
氯元素的相对原子质量为35.5,氯只有35Cl和37Cl两种稳定同位素,在氯气中35Cl和37Cl的原子个数比为3∶1,则相对分子质量为70,72,74的氯气分子数之比可能是( )
A.5∶3∶2 B.5∶2∶2
C.5∶2∶1 D.9∶3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com