
分析 I.(1)已知①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ•mol-1,
②C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1,
③2FeCO3(s)═2Fe(s)+2C(s)+3O2(g)△H=+1480kJ•mol-1,
根据盖斯定律可知,③×2+①+②×4可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H;
II.(2)①原子序数19~36位于元素周期表的第四周期;
②△n(H2)=6×△(Fe2O3),代入v=$\frac{△n}{V•△t}$计算;
③反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,当变化的量不变时,达到化学平衡状态,据此分析;
(3)参加反应的n(FeO)=0.04mol×50%=0.02mol,根据方程式知,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=$\frac{x-0.02}{1}$mol/L、c(CO2)=0.02mol/L,化学平衡常数K=$\frac{0.02}{x-0.02}$=0.5,据此计算x值;
III.(4)多元弱碱水解时,其第一步水解程度远远大于第二步,第二步水解程度远远大于第三步;
欲使平衡正向移动,可以采用加入和氢离子反应的物质、加水稀释、升高温度的方法.
解答 解:I.(1)已知①4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1648kJ•mol-1,
②C(s)+O2(g)═CO2(g)△H=-393kJ•mol-1,
③2FeCO3(s)═2Fe(s)+2C(s)+3O2(g)△H=+1480kJ•mol-1,
根据盖斯定律可知,③×2+①+②×4可得4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=(+1480kJ•mol-1)×2+(-1648kJ•mol-1)+(-393kJ•mol-1)×4=-260kJ•mol-1,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260kJ•mol-1;
II.(2)①原子序数19~36位于元素周期表的第四周期,因此原子序数为26的铁元素位于元素周期表的第四周期,
故答案为:四;
②△n(H2)=6×△(Fe2O3)=6×$\frac{4.8g}{160g/mol}$=6×0.03mol=0.18mol,
v(H2)=$\frac{△n}{V•△t}$=$\frac{0.18mol}{5L×2min}$=0.018mol•(L•min)-1,
故答案为:0.018mol•(L•min)-1;
③a.CH4的转化率等于CO的产率,与是否达到平衡状态无关,故a错误;
b.由M=$\frac{m}{n}$可知,M是一个变量,因此当混合气体的平均相对分子质量不变,达到化学平衡状态,故b正确;
c.v正(CO):v逆(H2)=1:2时,正、逆反应速率相等,达到化学平衡状态,故c正确;
d.该反应涉及固体和气体两种状态的物质,固体的总质量不变,说明达到化学平衡状态,故d正确;
故答案为:bcd;
(3)参加反应的n(FeO)=0.04mol×50%=0.02mol,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=$\frac{x-0.02}{1}$mol/L、c(CO2)=0.02mol/L,化学平衡常数K=$\frac{0.02}{x-0.02}$=0.5,x=0.06,
故答案为:0.06;
III.(4)多元弱碱水解时,因为每一步水解都生成氢离子,氢离子的存在抑制水解,所以其第一步水解程度远远大于第二步,第二步水解程度远远大于第三步,则存在K1>K2>K3,
a.加水稀释,促进水解,故正确;
b.加入少量NaCl固体,对反应无影响,故b错误;
c. 水解反应为吸热反应,升温,化学平衡正向移动,故c正确;
d.加入少量Na2CO3固体,降低了氢离子浓度,化学平衡正向移动,故d正确;
故答案为:K1>K2>K3;acd.
点评 本题考查化学平衡计算、盐类水解、化学平衡状态判断等知识点,为高频考点,侧重考查学生分析计算能力,只有反应前后改变的物理量不变时可逆反应就达到平衡状态,会化学平衡常数的有关计算,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:实验题
如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
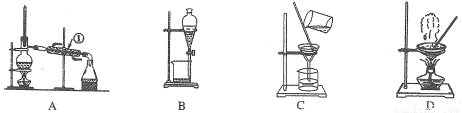
(1)从氯化钾溶液中得 到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的C1?等杂质,选择装置 。
到氯化钾固体,选择装置 (填代表装置图的字母,下同);除去自来水中的C1?等杂质,选择装置 。
(2)从碘水中分离出I2,选择装置 ,该分离方法的名 称为 。
称为 。
(3)装置A中①的名称是 ,进水的方向是从 口进水。装置B在分液时为使液体顺利滴下,除打开上口活塞外,还应进行的具体操作是 。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:

粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入略过量的盐酸 ⑤溶解 ⑥过 滤 ⑦蒸发
滤 ⑦蒸发
正确的操作顺序是 (填写序号)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(5)用化学方程式回答加入Na2CO3溶液的作用:_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
下列溶液中,K+的物质的量浓度最大的是( )
A.0.1 mol/L的KNO3 溶液500 ml B.0.05mol/L的K2SO4 溶液300ml
C.0.04mol/L的K3PO4 溶液100 ml D.0.06mol/L的KHCO3 溶液120 ml
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应Ⅰ是氧化还原反应,反应Ⅱ是非氧化还原反应 | |
| B. | H3PO2具有还原性,在空气中可能被氧化成磷酸 | |
| C. | 反应Ⅰ中氧化剂与还原剂的质量之比为1:1 | |
| D. | 反应Ⅰ中,在标准状况下生成2.24 L PH3时,转移0.3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 300 mL 1 mol•L-1NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com