
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 工业粉尘中含有Pb、Cd、Cr、V、As等金属元素,过量摄入均对人体有害 | |
| C. | 用工业明胶制作用药胶囊,会导致过量Cr元素摄入人体而提高致癌风险 | |
| D. | 分光光度计通过测定溶液颜色分析反应物(或生成物)浓度变化,从而确定化学反应速率 |
分析 A.利用原电池保护不活泼金属;
B.As为非金属元素;
C.Cr是重金属元素,摄入过量使人体蛋白质变性;
D.由利用溶液颜色与反应物(或生成物)浓度的关系,可以确定该化学反应的速率,分光光度计可进行比色分析.
解答 解:A.在海轮外壳上镶入锌块,形成原电池,锌作负极失电子,轮船外壳铁作正极被保护,可减缓船体的腐蚀速率,故A正确;
B.As为非金属元素,故B错误;
C.Cr是重金属元素,摄入过量使人体蛋白质变性,提高致癌风险,故C正确;
D.由利用溶液颜色与反应物(或生成物)浓度的关系,可以确定该化学反应的速率,分光光度计可进行比色分析,故D正确;
故选B.
点评 本题考查金属的腐蚀与防护、物质的性质,平时多积累这些基础知识,题目难度不大,注重化学与生活的联系.


科目:高中化学 来源: 题型:选择题
| A. | 铝和氢氧化钠溶液反应生成Al(OH)3和Na | |
| B. | 钠在空气中燃烧生成淡黄色的NaO2 | |
| C. | 铁在高温下与水蒸气反应生成Fe3O4和H2 | |
| D. | 用碳酸钠和氢氧化钙反应制NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)$?_{500℃}^{V_{2}O_{5}}$2SO3(g)△H=-196.6kJ/mol,若2molSO2完全反应则放出热量等于196.6kJ | |
| B. | “冰,水为之,而寒于水”说明相同质量的水和冰比较,冰的能量高 | |
| C. | 已知C(石墨)=C(金刚石)△H=+1.9kJ/mol,则从能量角度看金刚石比石墨稳定 | |
| D. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
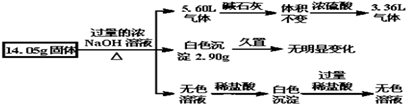
| A. | 一定含有Al,其物质的量为$\frac{5}{3}$mol | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有(NH4)2SO4和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用稀硫酸清洗过的铂丝分别蘸取溶液,在酒精灯外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
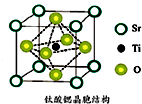 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.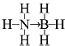 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2中所含阴离子的数目是0.2NA | |
| B. | 标准状况下,22.4 L SO3含分子数为NA | |
| C. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| D. | 用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com