
(14分)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:


已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
回答下列问题:
(1)加速卤块在H2O2溶液中溶解的措施有: (写出一条即可)。
(2)加入MgO的作用是 ;滤渣的主要成分为 。
(3)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为 ,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为①蒸发结晶;② ;③____;④过滤、洗涤。
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为: 。
。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-): ;
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数) 。
(1)将卤块粉碎或加热等;(2)调节溶液的pH,使Fe3+沉淀完全,BaSO4和Fe(OH)3
(3)MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,②趁热过滤,③冷却结晶;
(4)①ClO3-+5Fe2++6H+=6Fe3++Cl-+3H2O,②78.3%.
【解析】
试题分析:(1)影响化学反应速率的因素有三个温度、将固体粉碎成细小的颗粒、增加物质的浓度等。因此加速卤块在H2O2溶液中溶解的措施有将卤块粉碎或加热等;(2)金属氧化物MgO能与酸反应产生盐和水。所以加入MgO的作用是调节溶液的pH,使杂质Fe3+形成沉淀完全除去。根据示意图可知滤渣的主要成分为BaSO4和Fe(OH)3。(3)向滤液中加入NaClO3饱和溶液后,发生反应MgCl2+2NaClO3=Mg(ClO3)2+2NaCl,然后利用NaCl、Mg(ClO3)2的溶解度与温度的关系将溶液蒸发浓缩结晶、②趁热过滤,③冷却结晶,最后④过滤、洗涤。就得到Mg(ClO3)2·6H2O。(4)①步骤2中发生反应的离子方程式ClO3-+5Fe2++6H+=6Fe3++Cl-+3H2O,②在氧化反应反应中电子转移数目相等。n(Fe2+)×1=n(ClO3-)×6+n(Cr2O72-)×2×3. n(Fe2+)=0.02mol; n(Cr2O72-)=0.0015mol;所以n(ClO3-)={0.02mol×1-0.0015mol×2×3}÷6=0.0018mol;因此100ml中含有的ClO3-的物质的量为0.0183mol,则含有的Mg(ClO3)2·6H2O的物质的量为0.00915mol.去质量为299g/mol×0.00915mol=2.7408g.因此产品中Mg(ClO3)2·6H2O的质量分数为(2.7408g÷3.50 g)×100%=78.3%.
考点:考查物质的制备、加快化学反应速率的因素、反应条件的选择、混合物的分离及物质纯度的计算。


科目:高中化学 来源:2013-2014安徽省淮南市下学期期末考试高一化学试卷(解析版) 题型:选择题
赏心悦目的雕花玻璃可用下列物质中的一种对玻璃进行刻蚀而制成,这种物质是( )
A.盐酸 B.氢氟酸 C.烧碱 D.纯碱
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:选择题
在下列各组离子中,能大量共存的是
A.Ag+、NO-3、Na+、Cl- B.K+、HCO-3、Cl-、Al3+
C.NO-3、Fe2+、H+、Br- D.K+、NH4+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
下列除杂方法(括号内为杂质)操作正确的是( )
A.乙醇(水) 加新制的生石灰,过滤
B.乙烷(乙烯) 通过溴水溶液,洗气
C.溴苯(苯) 加水,振荡静置后分液
D.乙酸乙酯(乙酸) 加饱和NaHCO3溶液,振荡静置后蒸馏
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
某化学反应反应物的总能量大于生成物的总能量,则该反应( )
A.是吸热反应 B.是放热反应
C.不一定遵循质量守恒定律 D.不需要加热就一定能发生
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省合肥市高三第三次教学质量检测理综化学试卷(解析版) 题型:选择题
-定条件下,在体积为VL的密闭容器中发生如下反应 一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
一段时间后达到化学平衡状态。改变某一条件,下列说法正确的是
A.若升高温度,反应混合气体密度不变时即达到新平衡状态
B.若增大B的浓度,△H减小
C.若使用适当催化剂,A的转化率增大
D.若增大压强,平衡向右移动,则m+n>p+q
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) 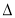 H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示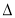 H,则
H,则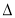 H= ;
H= ;
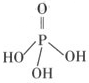
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两
个水分子产物,其结构式为 ,三聚
磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 ;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑ 请在答题卡上写出并配平反应式(a);
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;
原理上的不同点: ;
化学镀的优点: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列现象和应用与电子跃迁无关的是( )
A.激光 B.焰色反应 C.原子光谱 D.石墨导电
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放入Z的硝酸盐溶液中,Y表面有Z析出。三者的金属活动性顺序是( )
A. B.
B. C.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com